武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【AAV在卵巢中的应用】AAV介导的卵巢靶向基因递送能够恢复先天性不孕小鼠的生育能力
119 人阅读发布时间:2025-12-22 10:37
在生殖医学领域,不孕不育已成为全球突出健康问题,约20%人群面临自然受孕困境,其中女性不孕的核心成因多与卵母细胞发育异常、排卵障碍相关。卵发生作为一个复杂的生理过程,不仅依赖生殖细胞与体细胞(尤其是颗粒细胞)之间的卵巢内直接相互作用,还受垂体激素介导的反馈调节系统调控。卵母细胞与颗粒细胞的密切协作是卵泡正常发育的核心:出生时卵母细胞被单层卵泡上皮细胞包裹,这些细胞会发育为颗粒细胞,为卵母细胞提供生长、核成熟及获得发育潜能所需的营养物质和关键调控信号;颗粒细胞分泌的基底膜外环绕着卵泡膜细胞,三者共同构成卵泡结构,在周期性募集过程中,仅有少数卵泡能存活并发育至晚期,其余则发生闭锁(程序性的退化与消亡)。因此,颗粒细胞功能缺陷会直接破坏卵母细胞-颗粒细胞间的密切相互作用,进而导致女性不孕,而目前临床上尚无有效纠正颗粒细胞缺陷的治疗手段。
多种分子参与卵母细胞与颗粒细胞的交叉对话,KITL(干细胞因子)是关键介导分子之一,其存在可溶性(KITL1)和膜结合(KITL2)两种亚型。颗粒细胞表达的KITL与卵母细胞表面的受体KIT结合,调控卵泡生长的启动,且KIT与KITL还参与原始生殖细胞的存活,因此携带两者突变的动物生殖细胞数量减少,通常表现为不孕。此外,KIT可调控卵母细胞发育的多个阶段,包括原始卵泡发育启动、初级卵泡生长、窦前卵泡液形成及排卵前卵泡末次成熟。促卵泡激素(FSH)能够以双相方式调控KITL表达:低浓度FSH可增加膜结合亚型KITL2的相对丰度,进而激活卵母细胞的KIT受体;而高浓度FSH会升高KITL1/KITL2比值,但不能促进卵母细胞发育,凸显了KITL2的体内生理重要性。反之,卵母细胞以阶段特异性方式调控颗粒细胞中Kitl mRNA表达,因此Kitl对原始卵泡形成非必需,但对后续卵发生过程至关重要。
然而,通过调控卵母细胞微环境研究卵发生机制、治疗相关不孕的尝试,长期受限于血-卵泡屏障(BFB):BFB是由卵泡基底膜、颗粒细胞间紧密连接与卵泡周边血管相关结构共同构成的选择性通透结构,作为分子筛能阻隔分子量>20 nm的蛋白质与外源载体扩散;加之颗粒细胞依附基底膜、无直接血液供应,进一步提升了基因递送的难度。尽管基因治疗为纠正体细胞缺陷提供了方向,但卵巢基因转导存在两大核心难题:一是腺病毒(AdV)、慢病毒(LV)等传统病毒载体无法穿透BFB,难以有效感染颗粒细胞;二是转基因若整合至卵母细胞基因组,会引发生殖细胞遗传修饰的风险,限制临床应用前景。此前虽有AdV用于不孕治疗的尝试,但未取得成功,卵巢基因治疗仍主要集中于癌症治疗领域,基于病毒注射的卵巢基因疗法在治疗女性不孕症方面的有效性与安全性,仍有待深入研究与临床验证。
来自日本京都大学的Takashi Shinohara团队在Cell Reports Medicine期刊上发表了题为“Adeno-associated-virus-mediated gene delivery to ovaries restores fertility in congenital infertile mice”的研究成果。该研究提出核心假设:利用腺相关病毒(AAV)独特的转胞吞能力,突破BFB从而实现颗粒细胞靶向基因递送。尽管AAV直径略超BFB通透极限,但其转胞吞作用或可跨越该物理限制。基于此,团队通过体内实验筛选出高效穿透BFB并靶向颗粒细胞的AAV9血清型,优化转导效率后,将携带Kitl基因的AAV9显微注射至KitlSl-t/KitlSl-t突变小鼠卵巢基质。结果证实,该方法可实现颗粒细胞长期基因表达,重启卵发生过程,使突变小鼠通过自然交配产生无AAV基因组整合的健康后代。该研究不仅阐明了卵母细胞-颗粒细胞间相互作用的显著可塑性,更为人类女性不孕症的基因治疗开辟了新的潜在路径。

1、通过体内显微注射筛选AAV血清型
为验证BFB的通透性及筛选能有效穿透该屏障并感染颗粒细胞的AAV血清型,研究人员首先进行了预实验:向野生型(WT)小鼠卵巢显微注射异硫氰酸荧光素(FITC)标记的葡聚糖,通过玻璃针将注射物导入卵巢白膜下。结果显示,间质中可检测到强荧光信号,但卵泡内部未发现任何荧光,直接证实了BFB的物理阻隔作用。随后,研究人员构建了多种衣壳的AAV载体(AAV1、AAV6、AAV6.2、AAV7M8、AAV9、AAVDJ和AAVDJ8),所有载体均在广谱CAG启动子调控下表达红色荧光蛋白mCherry,以直观反映载体的感染效率和靶向性。将这些AAV分别显微注射到WT小鼠卵巢,7天后荧光检测发现,所有注射组均出现不同强度的荧光信号。为进一步明确各血清型对颗粒细胞的转导效果,研究者进行了免疫染色分析:以HSD3B(3β-羟类固醇脱氢酶)作为卵泡膜细胞标志物、AMH(抗缪勒管激素)作为颗粒细胞标志物,结果显示,卵泡膜细胞的荧光信号相对更强,且多数AAV极少感染AMH+颗粒细胞;而AAV9在颗粒细胞中表现出最强的荧光信号,同时未在卵母细胞中检测到任何AAV9荧光,且显微注射未影响卵巢卵泡发育,卵巢内可见形态正常的卵泡。综上,AAV9可穿透BFB感染颗粒细胞,且不转导卵母细胞,这一特性使其成为后续实验的最优选择。
为验证BFB穿透是否为AAV特有,研究人员以表达EGFP(增强型绿色荧光蛋白)的AdV或LV作为对照,进行同样的卵巢显微注射。结果显示卵泡内均未检测到EGFP信号。为进一步验证AAV9不感染卵母细胞,研究者采用了灵敏度更高的R26R-Eyfp报告小鼠模型。该小鼠的Gt(ROSA)26Sor基因座插入了loxP侧翼的STOP序列,其后紧跟Eyfp基因,当有Cre重组酶存在时,STOP序列被切割,Eyfp基因才会表达。研究者构建了表达Cre的AAV9变体,显微注射后2天即可在卵巢中检测到EYFP信号,且注射1个月后,AMH+颗粒细胞中的EYFP表达仍无显著衰减。尽管注射仅针对卵巢基质表层,但EYFP+细胞分布于整个卵巢,且卵母细胞内未检测到信号,再次确认AAV9对卵母细胞无感染活性。
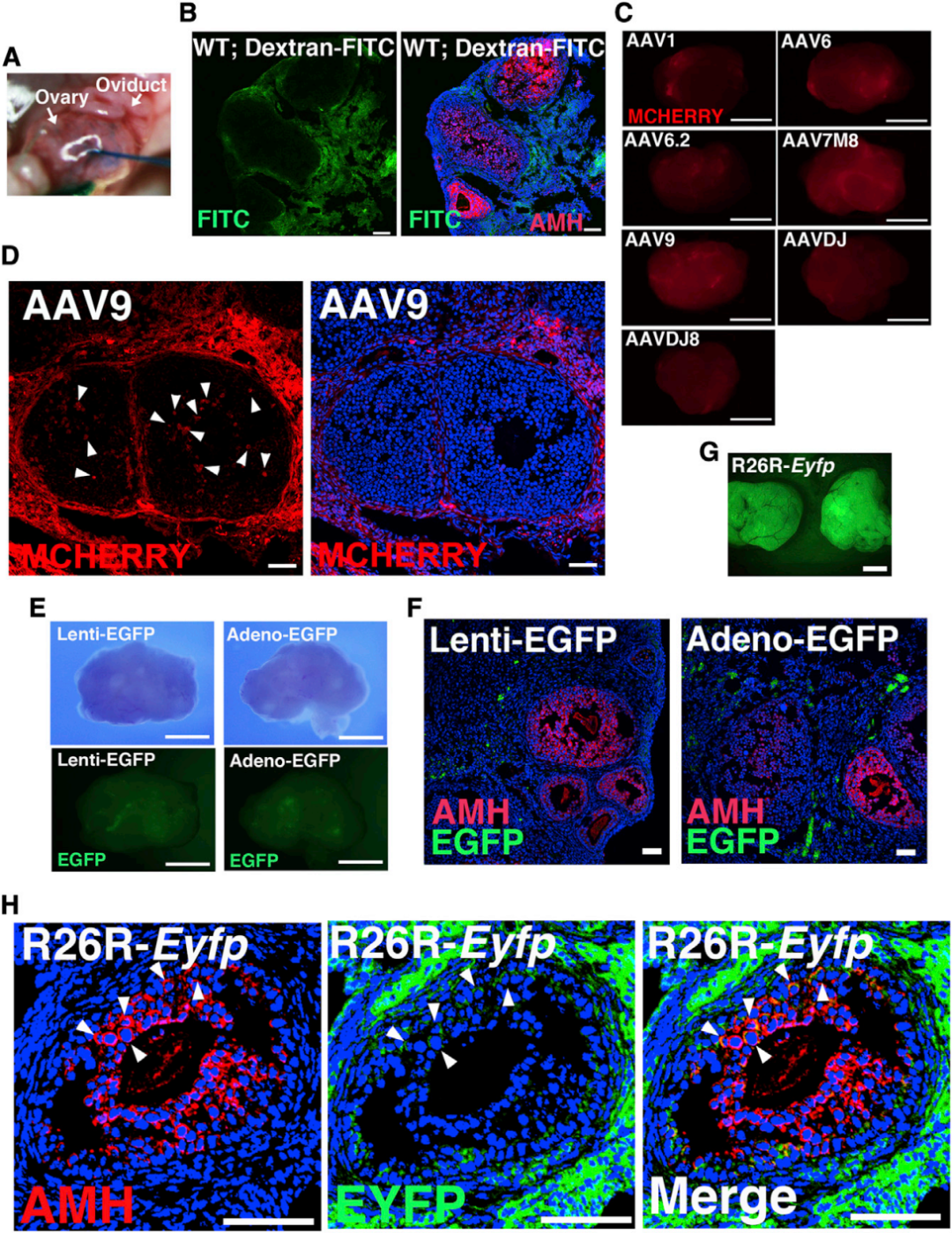
图1. AAV血清型的筛选
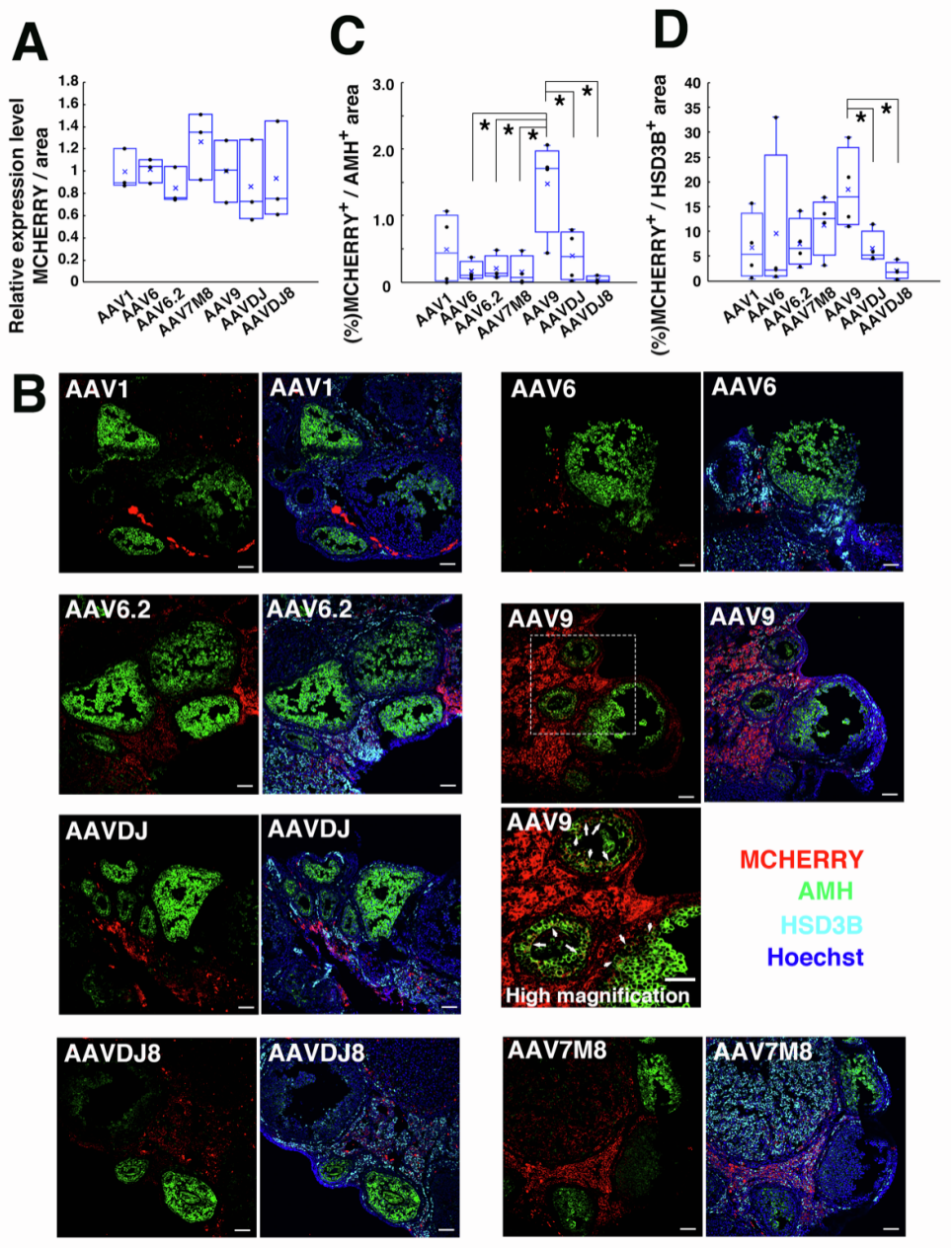
图2. AAV介导的卵巢转导
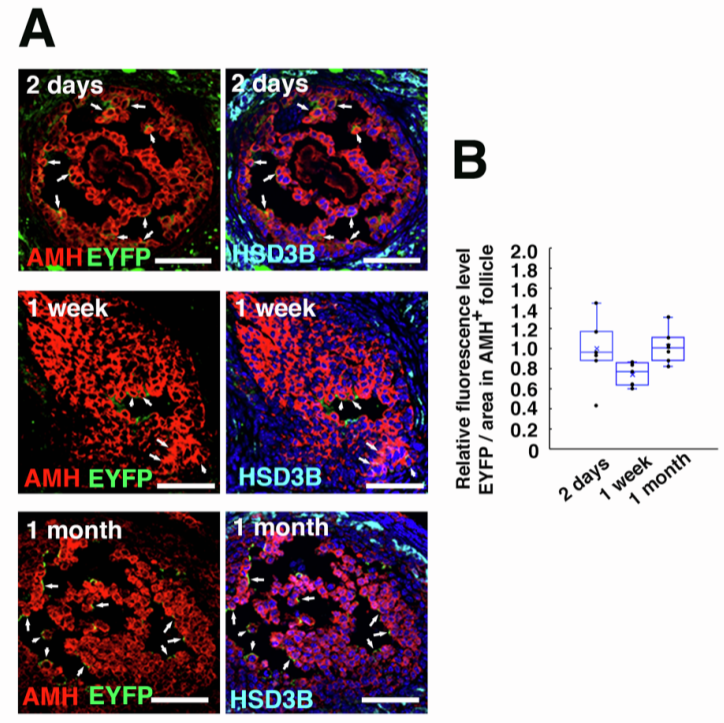
图3. AAV9-Cre介导的R26R-Eyfp小鼠卵巢转导
2、神经氨酸酶能够促进AAV9的转导
尽管AAV9已被证实能穿透BFB并感染颗粒细胞,但初步实验显示其转导效率仍有限。基于已有研究证实“神经氨酸酶可去除病毒靶细胞表面的末端唾液酸,显著提高AAV9在肺组织中的摄取”,研究人员推测神经氨酸酶可能同样能增强AAV9对卵巢细胞的转导效率。为此,研究者在WT小鼠卵巢中共注射AAV9-mCherry与神经氨酸酶(对照组仅注射AAV9-mCherry),1周后通过实时荧光定量聚合酶链式反应(qPCR)和蛋白质免疫印迹(WB)检测mCherry的表达水平。结果显示,神经氨酸酶共注射组的mCherry mRNA水平显著升高;尽管WB未检测到mCherry蛋白表达的统计学差异(可能与蛋白检测的时间点优化不足或检测灵敏度有关),但荧光观察显示,共注射组卵巢的mCherry荧光强度明显强于对照组,直观反映了蛋白表达的增强趋势。
免疫染色分析进一步证实,神经氨酸酶共注射增加了AMH+颗粒细胞和HSD3B+卵泡膜细胞中mCherry的表达区域。值得注意的是,尽管转导效率显著提升,卵母细胞中仍未检测到任何荧光信号,且联合注射后仍可见正常生长的卵母细胞;病毒注射后1周和1个月,不同发育阶段的卵泡数量无显著变化。以上结果表明,神经氨酸酶共注射可促进AAV9的转导,且不影响卵发生过程。
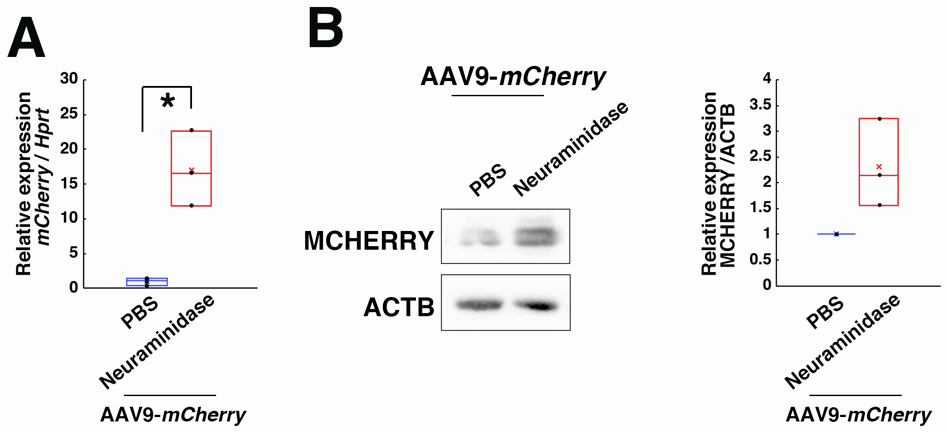
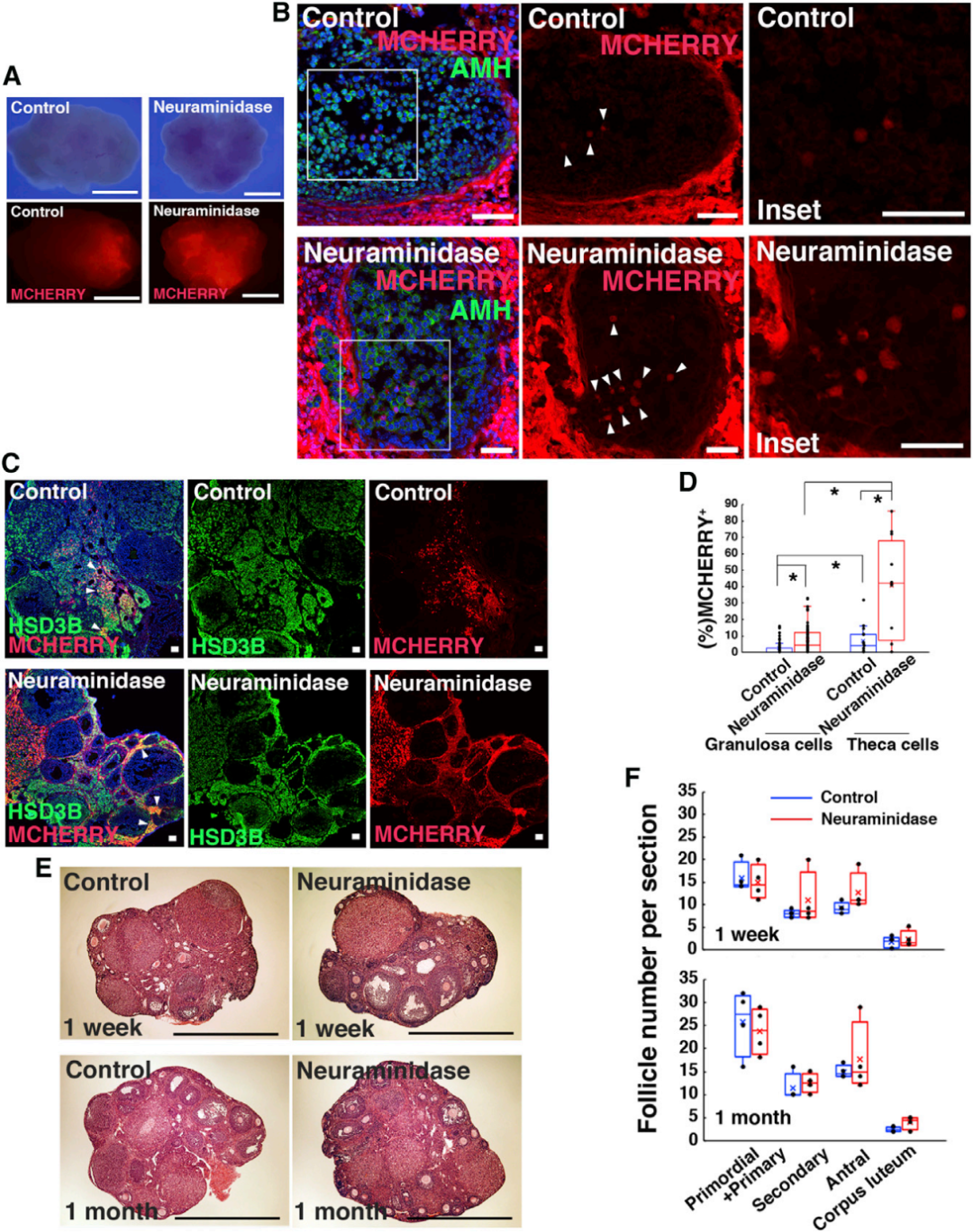
图4. 神经氨酸酶对AAV9转导的促进作用
3、AAV转导对生殖性能的影响
接下来,研究人员尝试通过表达Kitl来调控卵母细胞微环境,并观察其对小鼠正常生殖功能的影响。向10只WT雌性小鼠卵巢显微注射表达Kitl的AAV9(AAV9-Kitl);同时,向9只同龄WT雌性小鼠注射表达mNeonGreen(mNG,绿色荧光蛋白)的AAV9(AAV9-mNG)作为对照,部分样本联合注射神经氨酸酶以增强转导效率。qPCR结果显示,AAV9-Kitl注射组的Kitl表达升高,且神经氨酸酶辅助可显著增强Kitl表达;但WB未证实KITL蛋白的显著增加(可能与蛋白表达峰值时间点未准确捕捉有关)。随后,研究者在AAV注射1周后将所有小鼠与WT雄性小鼠交配,持续记录3个月内的生育情况。结果显示,AAV9-Kitl注射组小鼠仍能正常交配并产仔,窝仔数和产仔速度与对照组无显著差异;且8只生育小鼠中6只(对照组为7/9)3个月内可产两窝后代,表明Kitl过表达未耗尽卵母细胞库,对小鼠连续生殖能力无显著影响。
为深入探究Kitl过表达对卵巢组织的影响,研究人员对卵巢进行了组织学分析和免疫染色检测。结果显示,AAV9-Kitl注射组的卵发生过程整体正常,但多个区域的HSD3B+卵泡膜细胞数量显著增加,推测这一现象源于卵泡膜细胞同样表达KIT受体,Kitl过表达导致KIT信号通路非生理性过度激活。此外,次级卵泡数量显著减少,免疫染色证实HSD3B+卵泡膜细胞增多,但AAV9-Kitl与AAV9-mNG注射组的MKI67+(细胞增殖标志物)颗粒细胞数量无显著差异,表明Kitl过表达对颗粒细胞增殖无直接影响。尽管卵泡膜细胞数量显著增加,Kitl过表达未诱导卵母细胞凋亡,且卵巢组织中未检测到CD4+或CD8+免疫细胞的明显浸润,表明AAV9转导不会引发显著的炎症反应。最关键的是,对所有后代进行PCR检测,均未发现AAV载体的转基因整合。综上,AAV9-Kitl过表达可支持完整的卵发生过程,且无转基因整合到卵母细胞基因组的风险。
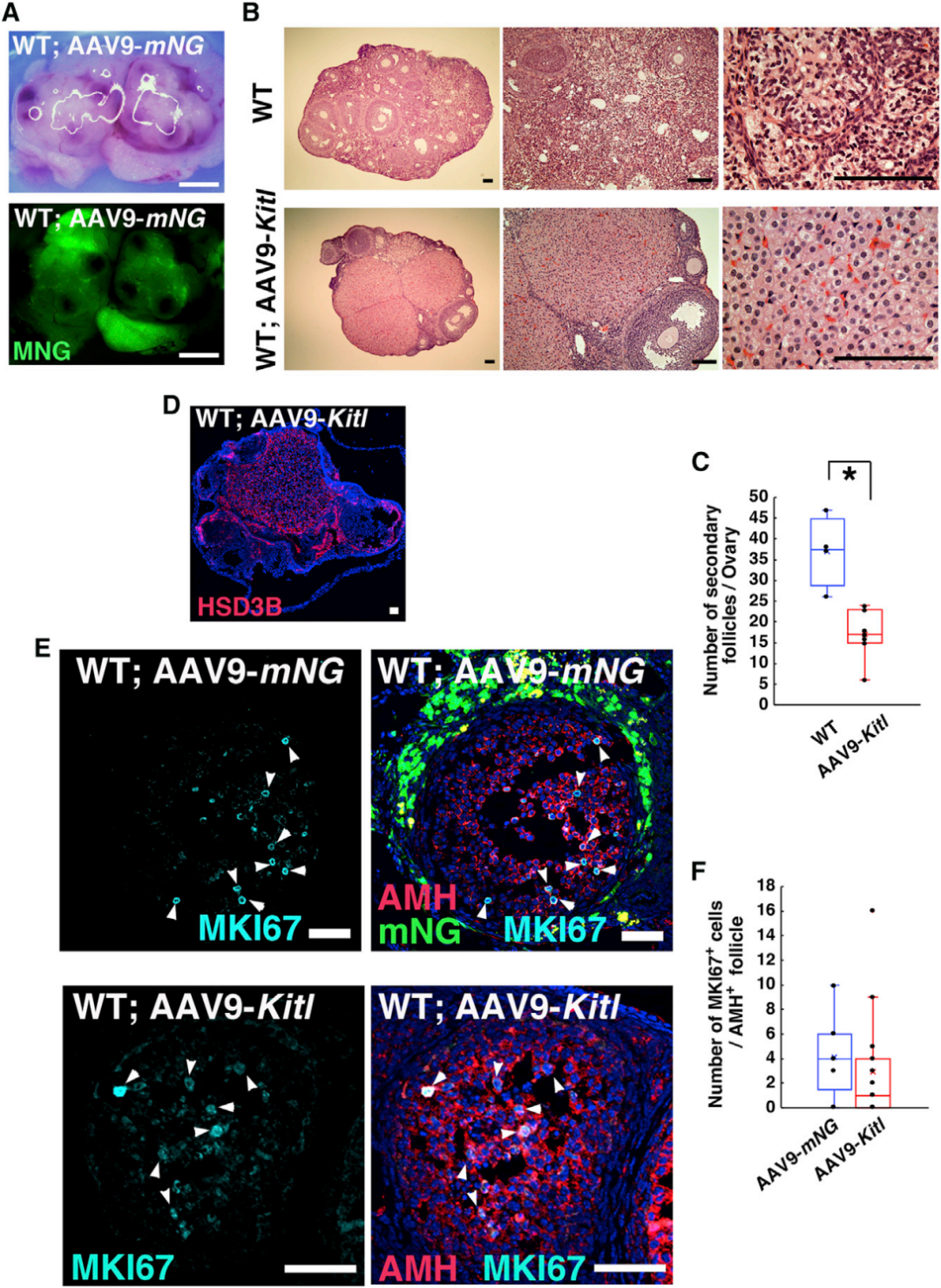
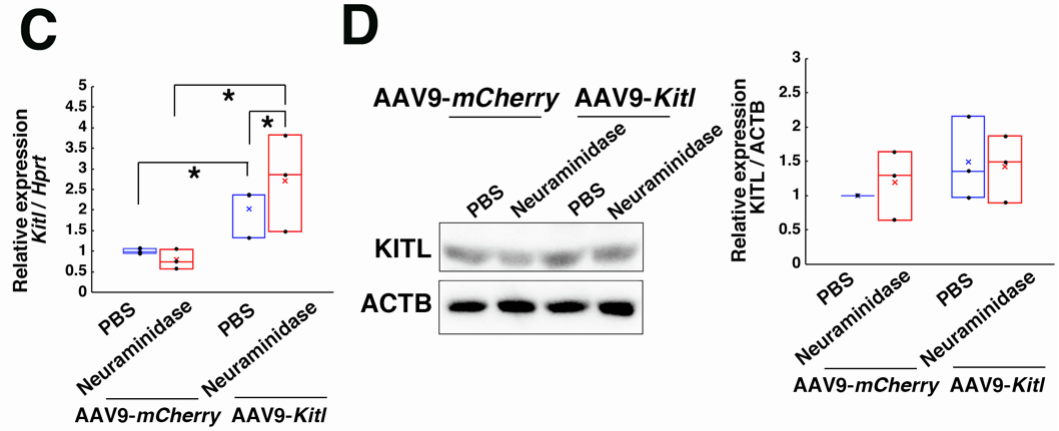
图5. AAV9-Kitl转导在WT小鼠中的功能分析
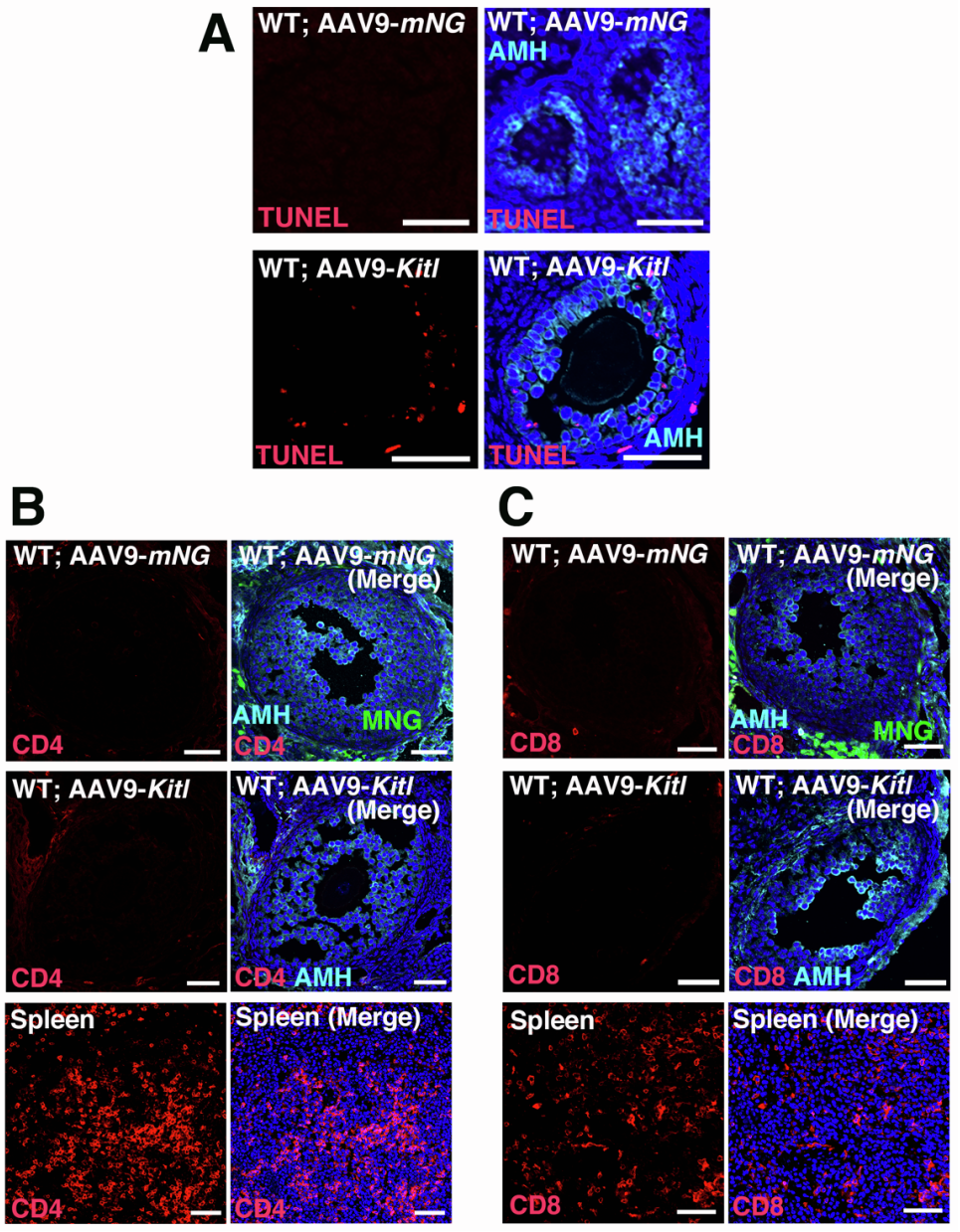
图6. AAV转导后的凋亡与炎症分析
4、AAV转导对先天性不孕小鼠模型生育能力的恢复作用
为验证AAV9-Kitl对先天性不孕的治疗效果,研究人员采用了KitlSl-t/KitlSl-t突变小鼠模型——该模型因Kitl基因突变(KitlSl-t)导致卵子发生缺陷从而导致先天性不孕,是研究KITL功能及相关不孕治疗的理想模型。首先,研究人员对该突变体的表型进行了系统表征:与WT小鼠相比,KitlSl-t/KitlSl-t雄性小鼠可育,睾丸大小正常;而雌性小鼠卵巢体积显著缩小,组织学分析显示所有卵泡均停滞于早期阶段,仅含单层颗粒细胞。生殖性能测试证实,超过100只雌性突变体与雄性小鼠合笼后均未产仔。血清激素检测显示,突变体小鼠的雌激素水平显著低于WT,而FSH和促黄体生成素(LH)水平显著升高——这与人类早发性卵巢功能不全的表型高度相似,进一步验证了该模型的临床相关性。
基因序列分析显示,KitlSl-t/KitlSl-t小鼠的Kitl基因存在两处点突变:第42位(T/C)为沉默突变,不改变氨基酸序列;第619位(G/T)的点突变导致第207位氨基酸由丙氨酸变为丝氨酸。但由于雄性突变体的精子发生正常(而精子发生同样依赖KITL-KIT信号通路),研究人员推测该氨基酸突变并非卵巢缺陷的直接原因;逆转录PCR(RT-PCR)结果显示,雌性突变体卵巢中未检测到Kitl mRNA表达,因此推测KitlSl-t表型相关的突变可能破坏了调控机制,导致卵巢Kitl mRNA缺失。
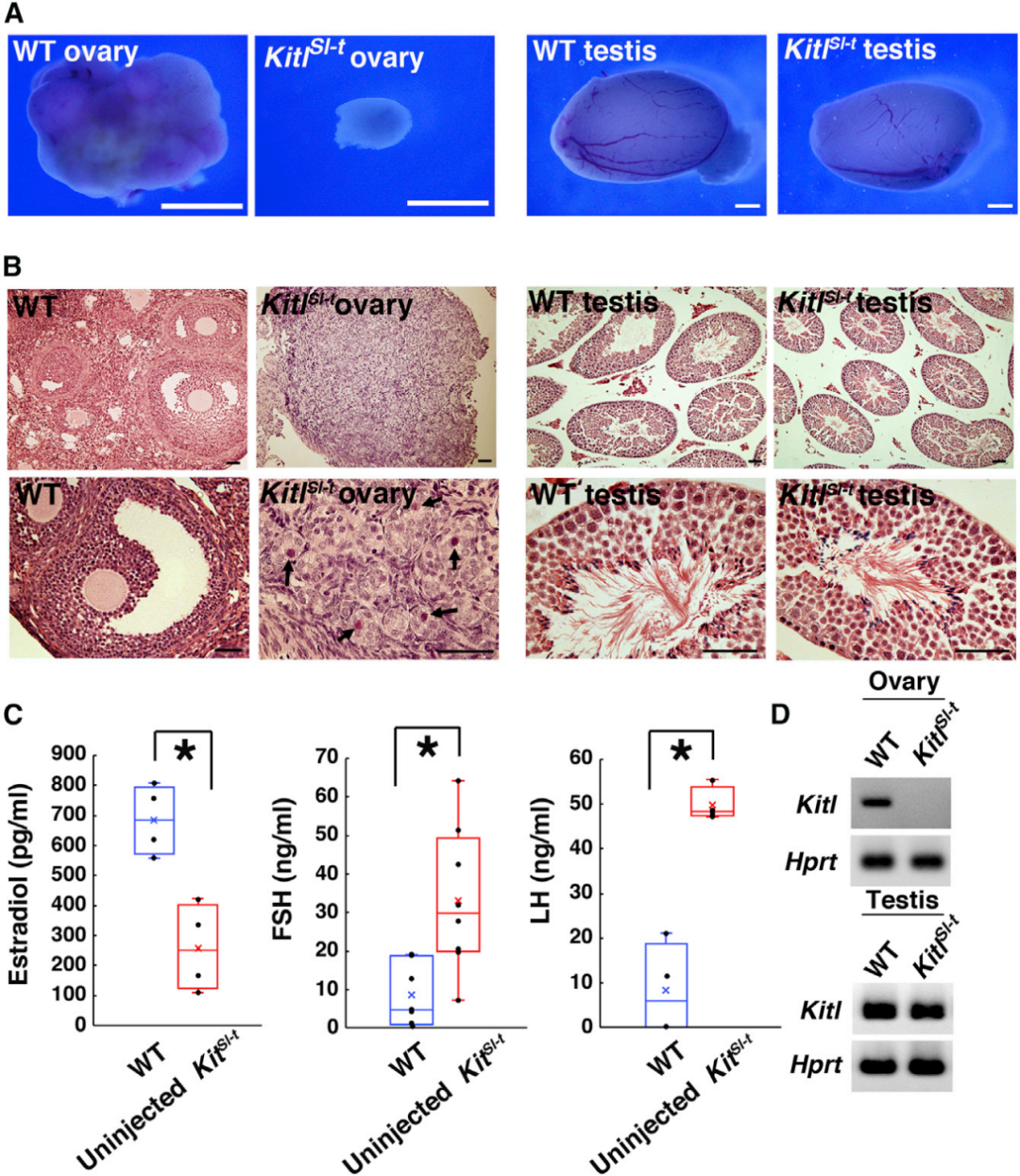
图7. KitlSl-t/KitlSl-t突变小鼠的表型分析
基于上述表征,研究团队向成年雌性KitlSl-t/KitlSl-t小鼠卵巢显微注射AAV9-Kitl,部分联合注射神经氨酸酶以增强转导效率。qPCR结果显示,AAV9-Kitl注射能有效恢复突变体卵巢的Kitl表达,尽管表达水平仍低于WT卵巢。组织学分析显示,与未注射组的小体积卵巢相比,AAV9-Kitl注射组的卵巢体积显著增大,且卵巢组织中出现发育中的卵泡——尽管生长卵泡的频率较低,但这些卵泡体积更大,部分含两层以上颗粒细胞,表明AAV9-Kitl介导的Kitl表达不仅能重启卵发生过程,还能诱导颗粒细胞增殖。值得注意的是,尽管WT小鼠实验中观察到卵泡膜细胞增多,且持续KIT信号可能引发肿瘤形成,但突变体卵巢中未发现任何肿瘤样结构或卵泡膜细胞异常扩张,安全性良好;而注射AAV9-mCherry的对照组突变体卵巢中,仍未检测到任何生长卵母细胞,证实Kitl基因的功能性表达是卵发生恢复的关键。
随后,将剩余AAV-Kit注射后的KitlSl-t/KitlSl-t雌性小鼠与纯合KitlSl-t/KitlSl-t雄性小鼠交配,验证生育能力是否恢复。结果显示在5次独立实验中,19只接受AAV9-Kitl注射的突变体小鼠中,8只(42.1%)成功恢复生育能力。最早在注射后62天即诞生首窝后代,性别比例正常;首窝平均产仔时间为65.6天,注射后126天内无新后代诞生;平均每窝后代数为3.1±0.7只(n=9),后代出生时形态正常。所有后代性成熟后,雌性因继承了父母的KitlSl-t突变而不孕,雄性可育;且所有成熟后代均表现为该品系特有的白色皮毛(源于黑素细胞缺乏)。尽管样本量有限,无法证实神经氨酸酶共注射对生育恢复率的显著影响,但数据显示提高病毒浓度可增加生育恢复率,为后续优化治疗方案提供了方向。此外,外周血激素水平动态监测显示,与未处理的突变体相比,AAV9-Kitl转导小鼠的FSH水平在注射后10天内显著下降,LH水平直至注射后70天才出现显著降低,而雌激素水平未观察到显著变化。
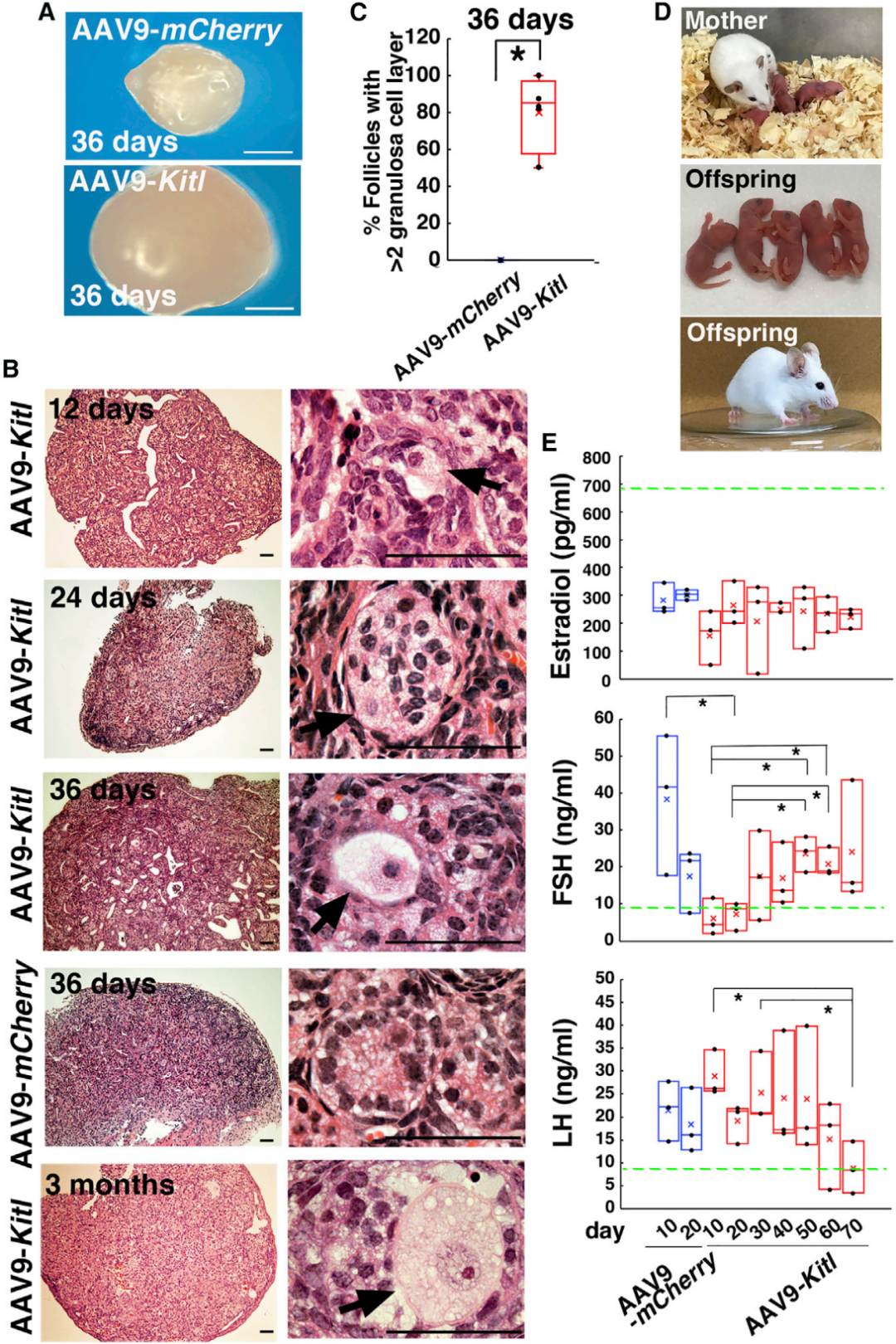
图8. AAV9-Kitl转导对KitlSl-t/KitlSl-t突变雌性小鼠不育症的挽救作用
表1. 注射AAV9-Kitl后KitlSl-t/KitlSl-t突变小鼠的后代情况

5、后代的DNA分析
为确保该基因治疗策略的生殖安全性,研究者对AAV9-Kitl治疗所生的后代进行了系统的DNA分析。DNA印迹法(Southern blot)、PCR等分子检测实验均未在后代基因组中发现AAV载体序列的整合。此外,考虑到雌性生殖细胞的基因组印记发生在出生后,Kitl过表达可能干扰DNA印记过程,研究者通过亚硫酸氢盐限制性内切酶分析(COBRA)和亚硫酸氢盐测序分析了后代中两个重要印迹控制区域的DNA甲基化状态,结果显示后代的DNA甲基化模式完全正常。以上结果共同表明,AAV9-Kitl注射后的卵巢能产生功能正常的卵母细胞,这些卵母细胞受精后可发育为基因组完整、印记正常的健康后代,证实了该基因治疗策略的安全性。
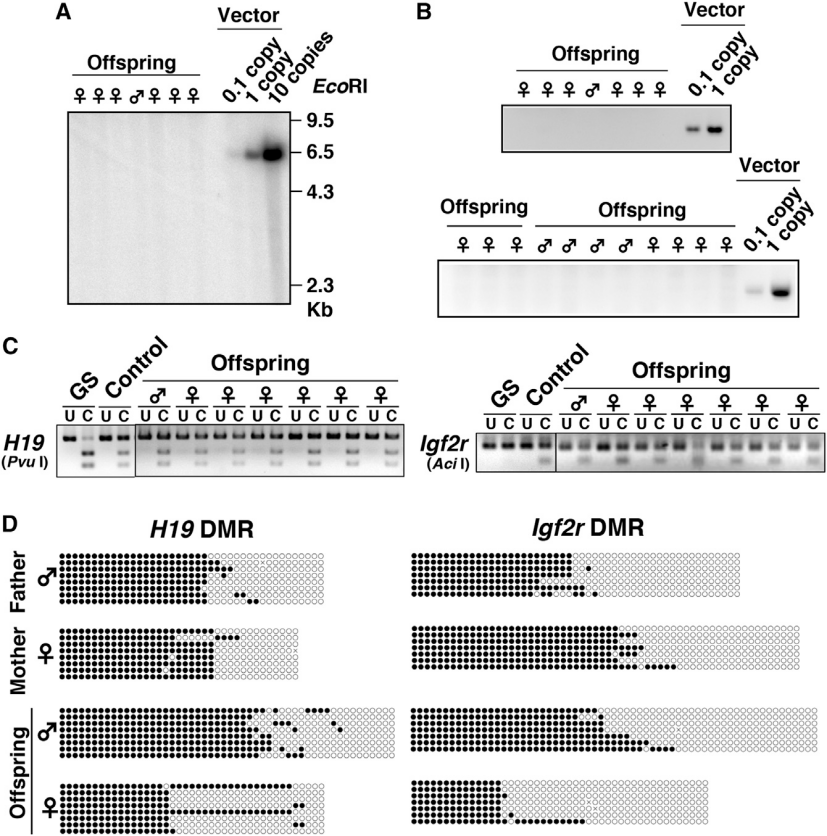
图9. 后代的DNA分析
总结
综上,该研究核心成果在于证实了AAV9载体可有效穿透BFB,实现对卵巢颗粒细胞的靶向基因递送。通过向KitlSl-t/KitlSl-t先天性不孕小鼠卵巢显微注射AAV9-Kitl,成功恢复突变体的卵子发生,使小鼠(42.1%)通过自然交配产生无转基因整合的健康后代。该成果不仅为在体研究卵母细胞-颗粒细胞互作提供了新工具,更验证了AAV介导的基因治疗在体细胞缺陷型女性不孕中的应用潜力,为人类相关疾病的治疗开辟了新路径。
同时,研究也客观指出了局限性:一是转导效率与生育恢复率待提升,超半数注射小鼠未受孕,仅少数能多次产仔;二是转导后FSH、LH水平异步变化,激素调控分子机制仍不明确;三是缺乏小鼠生殖寿命长期评估,AAV9对人类卵巢的感染效率与靶向性未验证,物种差异可能影响临床转化。未来需优化AAV衣壳以提高颗粒细胞靶向转导效率,结合卵母细胞体外培养提升卵发生恢复效果,同时深入解析AAV穿透BFB及KITL-KIT通路调控机制,在非人灵长类模型中验证安全性,推动临床转化。
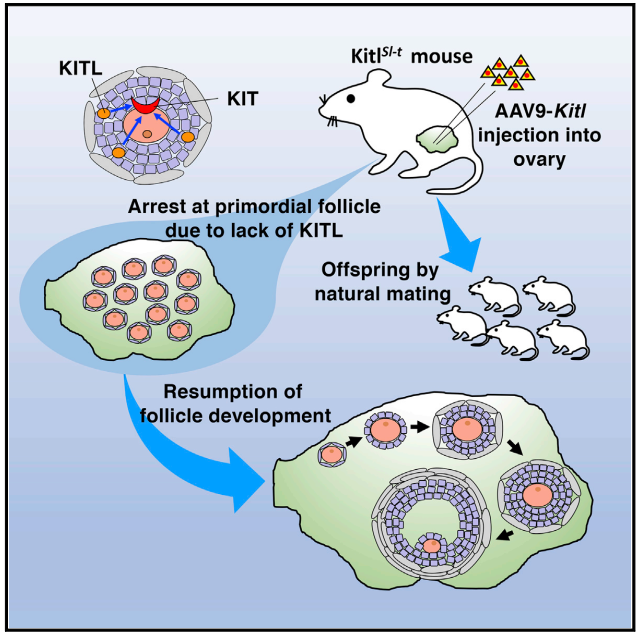
总结图
本文使用的病毒产品,列表如下:
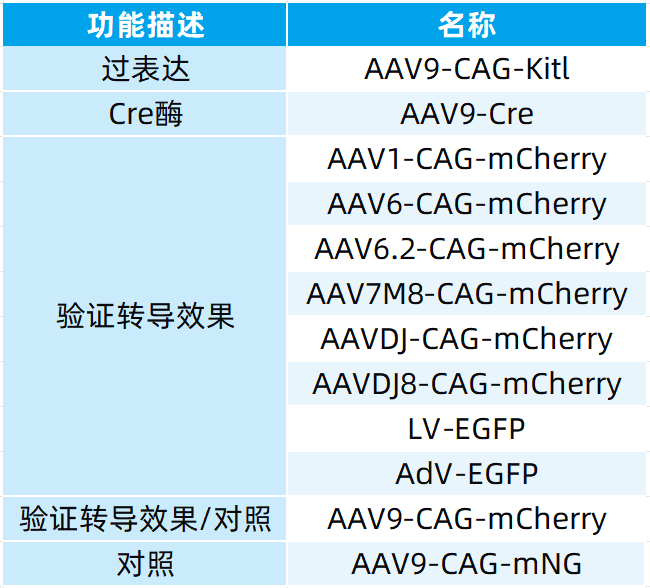
如有相关需求,或了解更多产品服务,欢迎咨询我们!点击进入店铺,查看更多产品及服务