武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【客户文章】中科大熊伟团队在解析本能防御行为的神经环路方面取得新进展
1970 人阅读发布时间:2023-08-04 11:32
对于动物而言,生存的危险无处不在。漫长的进化过程赋予低等动物到高等动物许多共有的本能行为来帮助其更好的生存繁衍,如觅食、交配及哺育后代行为等[1]。然而,在充满危险的自然环境中,这些行为发生时随时可能会出现捕食者。因此,猎物必须相对应的进化出一系列防御行为来应对潜在的和已经发生的生存危机。
动物应对危险的防御行为多种多样,常见的有惊跳反射(startle reflex)、冻结、躲避、逃跑和战斗等。其中,惊跳反射是机体响应于外界突然的声音或触觉刺激产生的一种快速的下意识反应,主要表现为闭眼、面部和头颈部收缩及全身弹跳等。惊跳反射存在于所有哺乳动物的整个生命周期中,它的产生可以将机体多处肌肉收缩反应紧急调动起来,保护容易受伤的部位,如眼睛与后颈部,也为后续进一步的防御反应做好准备。此外,惊跳反射的程度可以指征机体的焦虑状态,其异常更是与创伤后应激障碍症(Post-traumatic stress disorder, PTSD)、恐慌症(Panic disorder, PD)等精神类疾病密切相关[2 - 4]。尽管惊跳反射是一种重要的本能防御行为,但是控制惊跳反射的基本神经环路尚不清楚。
2021 年 11 月 4 日,中国科学技术大学生命科学与医学部熊伟教授课题组在Nature Communications发表了题为「A brainstem reticulotegmental neural ensemble drives acoustic startle reflexes」的研究论文,揭示了耳蜗核-脑桥尾侧网状核-脊髓运动神经元这条神经环路在调控惊跳反射行为中的重要作用。

在本研究中,课题组首先在小鼠上建立声音诱发惊跳反射(Acoustic startle reflex, ASR)行为学模型。小鼠接受声音刺激后,位于脑干的脑桥尾侧网状核(Reticulotegmental nucleus, RtTg)神经元 c-fos 表达显著上升(图 1a-c),并且这些神经元主要为谷氨酸能神经元(图 1d)。进一步的在体光纤记录结果表明,ASR 情况下,RtTg 内谷氨酸能神经元能稳定记录到响应于声音刺激的钙信号上升(图 1e-i)。这提示 RtTg 核团可能与小鼠的惊跳反射行为有关。
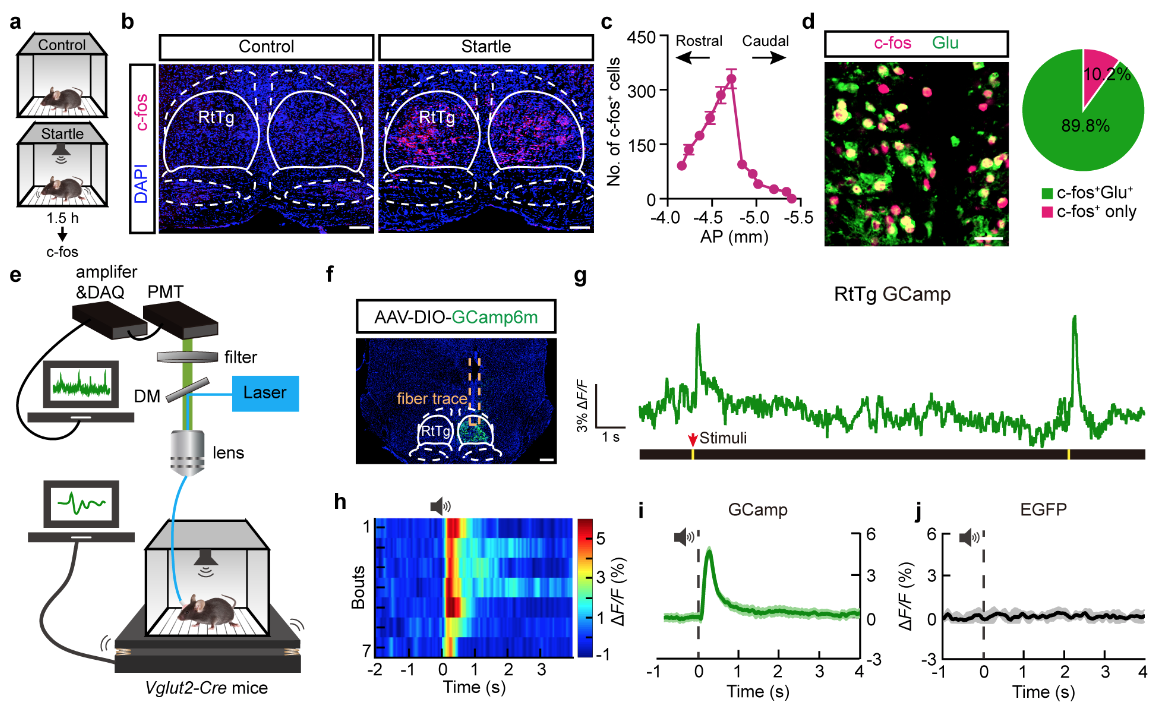
图 1. 声音刺激诱发惊跳反射时,小鼠 RtTg 内谷氨酸能神经元被激活
那么,直接激活 RtTg 核团是否会诱发小鼠产生惊跳反射呢?为了探究这一可能性,研究人员将表达 ChR2 的光遗传病毒注射到 RtTg 内(图 2a),发现蓝光激活 RtTg 神经元后,小鼠表现出弹跳行为(图 2d-g),颈部及后肢肌肉也能同步记录到肌电活动(图 2 h-j),这是典型的惊跳反射行为。
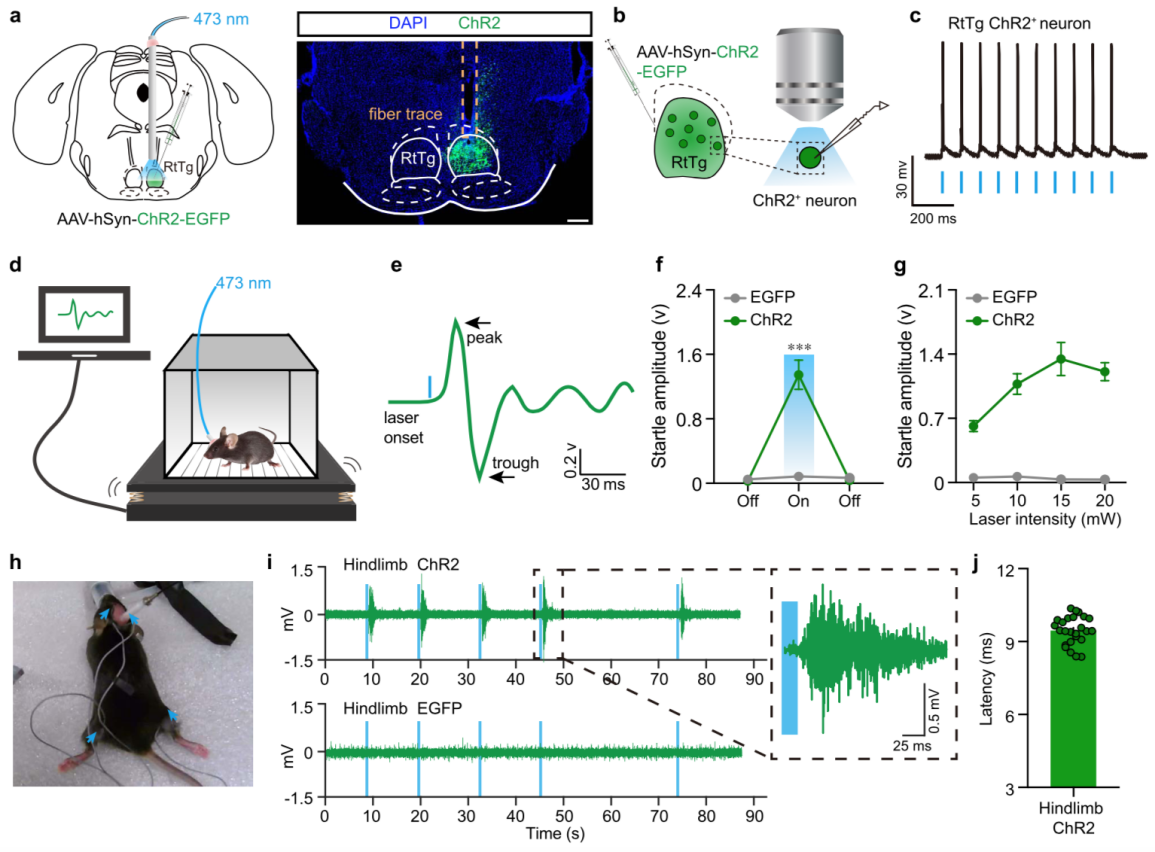
图 2. 光遗传激活 RtTg 核团诱发小鼠产生惊跳反射
随后,研究人员将表达 hM4Di 的化学遗传病毒注射到 RtTg 内(图 3a)。结果表明,当 RtTg 核团神经元被抑制时,声音诱发小鼠产生的惊跳反射幅度显著降低(图 3b)。并且,化学遗传抑制 RtTg 核团并不会影响小鼠的运动协调、步态及痛觉感知等(图 3c-i),这说明 RtTg 特异性介导小鼠的惊跳反射行为。
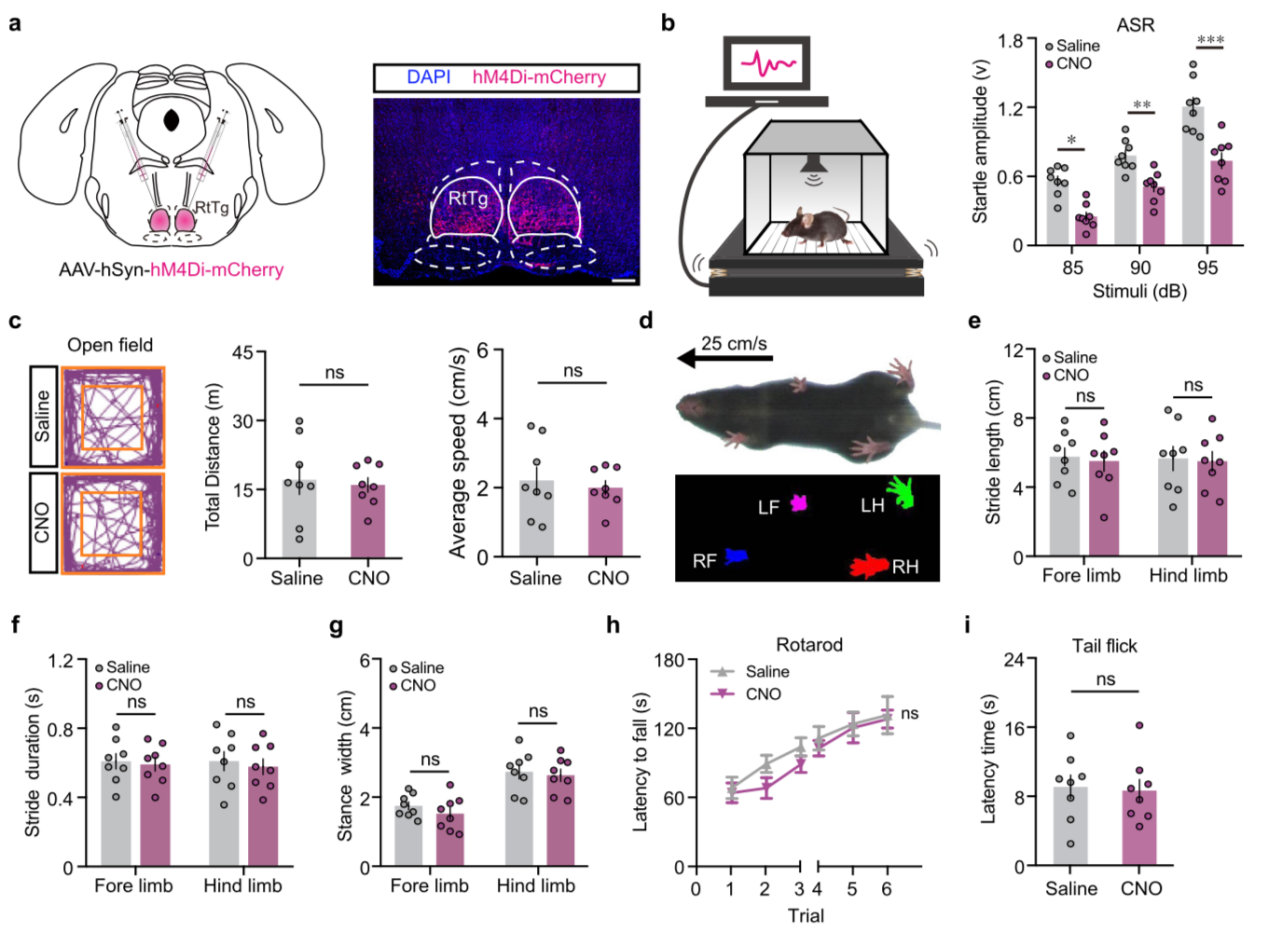
图 3. 化学遗传抑制 RtTg 核团后小鼠惊跳反射幅度降低
耳蜗核(cochlear nucleus, CN)是脑内接收并进一步传递声音信息的第一级核团。既然 RtTg 核团在小鼠上参与调控声音诱发的惊跳反射行为,那么,CN 与 RtTg 之间是否存在环路投射呢?为了回答这一问题,研究人员首先在 CN 内注射 AAV-EGFP,在 RtTg 内观察到 EGFP 标记的绿色荧光末梢(图 4a-c)。随后,研究人员在 Ai9(Rosa-tdt)小鼠 CN 内注射跨突触的 AAV2 / 1 -Cre,结果在 RtTg 内检测到 tdt 标记的神经元(图 4d-f)。RtTg 内注射 Retro-AAV-EGFP 后,CN 内也能检测到 EGFP 标记的神经元信号(图 4 g-j)。这些结果提示 CN-RtTg 间存在直接投射。
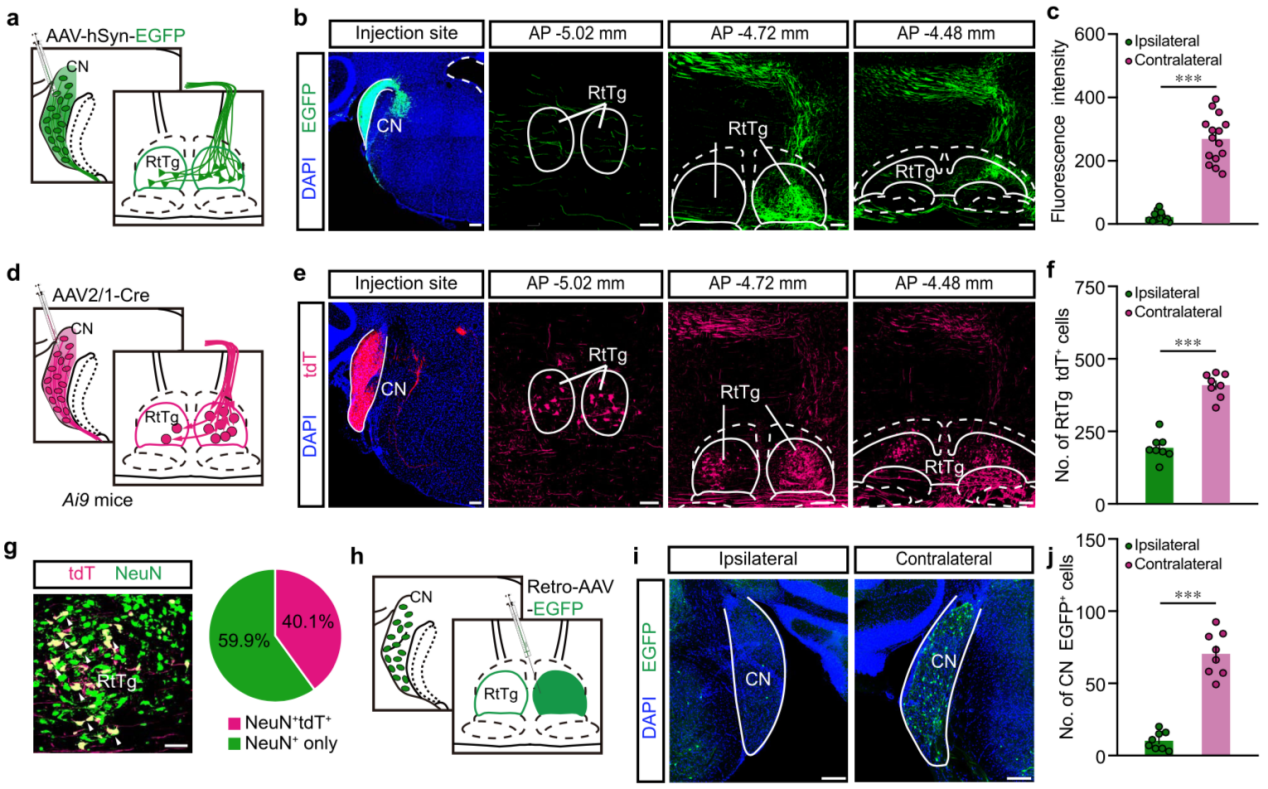
图 4. CN 直接投射到 RtTg 核团
随后,研究人员对 CN-RtTg 投射进行了性质及功能鉴定。染色发现接受 CN 投射的 RtTg 神经元主要是谷氨酸能的(图 5a-b)。脑片电生理记录表明,CN 发出兴奋性谷氨酸能投射到 RtTg 神经元(图 5c-d)。光遗传特异性激活 CN-RtTg 谷氨酸能投射,同样可以在小鼠上诱发惊跳反射(图 5e-f)。
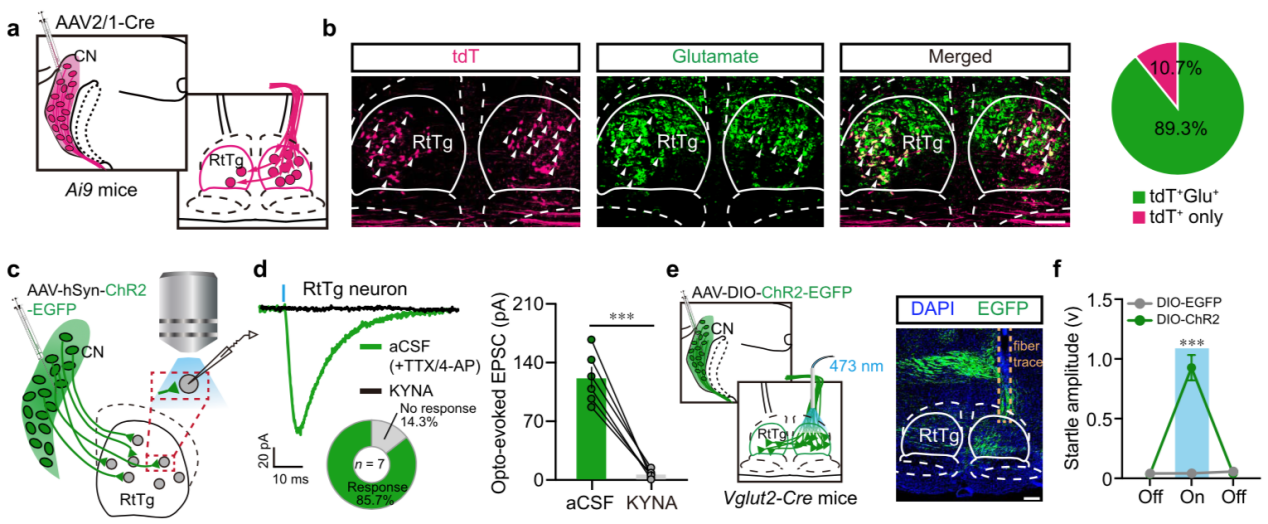
图 5. 兴奋性 CN-RtTg 投射介导惊跳反射
惊跳反射的最终表现是机体四肢及多处肌肉的收缩,这些功能的完成需要脊髓的支配。既然 RtTg 核团控制惊跳反射,那么它应该与脊髓存在环路连接。Ai9 小鼠 RtTg 内注射跨突触的 AAV2 / 1 -Cre 病毒后,在脊髓颈段与腰段观察到 tdt 标记的运动神经元(Spinal motor neurons, MNs, 图 6a-b)。而从肌肉使用缺陷型狂犬病毒逆追,再次证明 RtTg 与脊髓运动神经元之间存在直接联系(图 6c-d)。更进一步的追踪实验结果表明, RtTg 谷氨酸能神经元在接受 CN 的输入后,直接投射到脊髓运动神经元,最终完成对颈部及四肢肌肉的控制(图 7)。
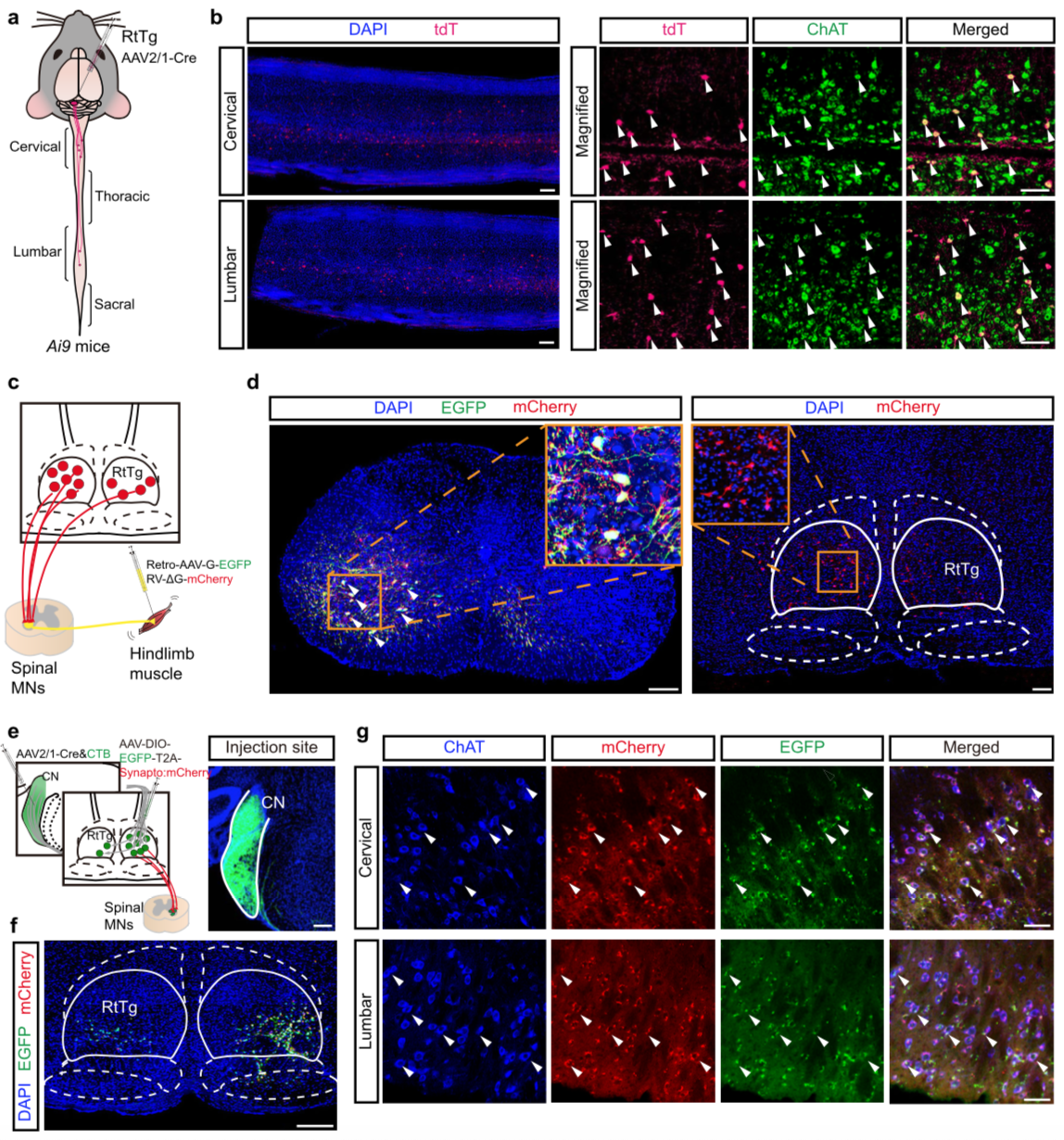
图 6. 鉴定 CN-RtTg-spinal MNs 三级投射
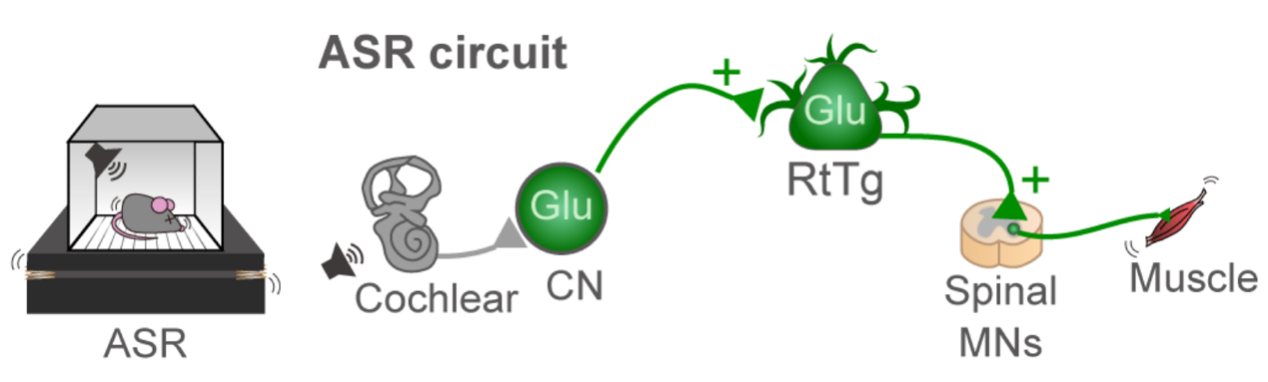
图 7. CN-RtTg-spinal MNs 环路介导声音诱发惊跳反射行为的环路示意图
总的来说,该研究首次鉴定了一条 RtTg 介导的控制惊跳反射的神经环路,加深了目前对本能防御行为神经机制的认识,也为后续进一步研究创伤后应激障碍、恐慌症等疾病中出现的惊跳反射异常行为提供了新的方向。
中国科大熊伟课题组郭薇薇博士和范思佳博士为本文的共同第一作者,生医部熊伟教授为本文的通讯作者。该研究得到了基金委、科技部、中科院和中国科学技术大学的大力支持。
本文使用的来自枢密科技的病毒产品:

参考文献:
[1] LeDoux J., and Daw ND. (2018). Surviving threats: neural circuit and computational implications of a new taxonomy of defensive behaviour. Nat Rev Neurosci.19, 269 - 282.
[2] Boecker, L., and Pauli, P. (2019) Affective startle modulation and psychopathology: Implications for appetitive and defensive brain systems. Neurosci. Biobehav Rev. 103, 230–266.
[3] Morgan, C. A. 3rd, Grillon, C., Southwick, S. M., Davis, M., and Charney, D. S. (1995). Fear-potentiated startle in posttraumatic stress disorder. Biol. Psychiatry 38, 378–385.[4] Grillon, C., Ameli, R., Goddard, A., Woods, S. W., and Davis, M. (1994). Baseline and fear- potentiated startle in panic disorder patients. Biol. Psychiatry 35, 431–439.
文章链接:https://www.nature.com/articles/s41467 - 021 - 26723 - 9
长按下载原文