武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【客户文章】苏州大学徐璎教授揭示视交叉上核调控小鼠棕色脂肪产热机制
85 人阅读发布时间:2025-12-16 08:56
视交叉上核(SCN)作为哺乳动物生物钟核心中枢,通过神经与体液途径协调全身代谢组织稳态以适配昼夜节律,其功能紊乱(如轮班、跨时区旅行诱发)易致代谢异常,增加肥胖等疾病风险,且SCN损毁(SCNx)小鼠会出现肥胖、胰岛素抵抗,还会阻断仓鼠和大鼠食物剥夺时的蛰伏行为,但其调控机制不明;棕色脂肪组织(BAT)是小鼠非战栗产热核心器官,冷刺激下经交感神经系统(SNS,受SCN昼夜节律调控)激活,以脂肪酸或葡萄糖为底物产热。禁食时则下调产热节能。虽BAT受SNS直接支配,但SCN对脂肪组织的调控高度依赖温度、饮食模式等环境因素,具体调控网络与分子机制仍需深入解析。
2025年12月4日,苏州大学徐璎教授课题组在Plos Biology期刊(IF=7.2)在线发表了题为“The suprachiasmatic nucleus regulates brown fat thermogenesis in male mice through an adrenergic receptor ADRB3-S100B signaling pathway”的研究论文。作者通过构建SCNx小鼠模型,以及时间限制性饮食(TRF,21℃)(亚热中性环境STE)营养-温度双重压力模型,结合单细胞核RNA测序(snRNA-seq),病毒示踪以及病毒干预等方法,明确SCN通过SNS-β3肾上.腺素能受体(ADRB3)环路及核心分子S100钙结合蛋白B(S100B)调控BAT细胞增殖与衰老,进而调控BAT产热活性。该研究首次揭示SCN在应激下的调控作用及核心通路,为相关疾病干预提供新机制与靶点。

为探究SCN在营养与热应激联合作用下的产热适应调控机制,作者采用了时间限制性饮食-温度应激(TRF-STE)模型,该模型此前已被证实可诱导野生型(WT)小鼠出现体温过低。实验中,小鼠的进食时间被严格限制在4小时窗口期(ZT16-ZT20)内。在21℃条件下,假手术组小鼠(sham小鼠)于ZT20停止进食后,其核心体温(CBT)及BAT温度均出现显著的下降,这一现象与禁食状态下的低温适应特征相符。值得注意的是,SCNx小鼠在第二个TRF周期中的低温反应明显减弱,在21℃环境下,其CBT和BAT产热均显著高于sham小鼠。
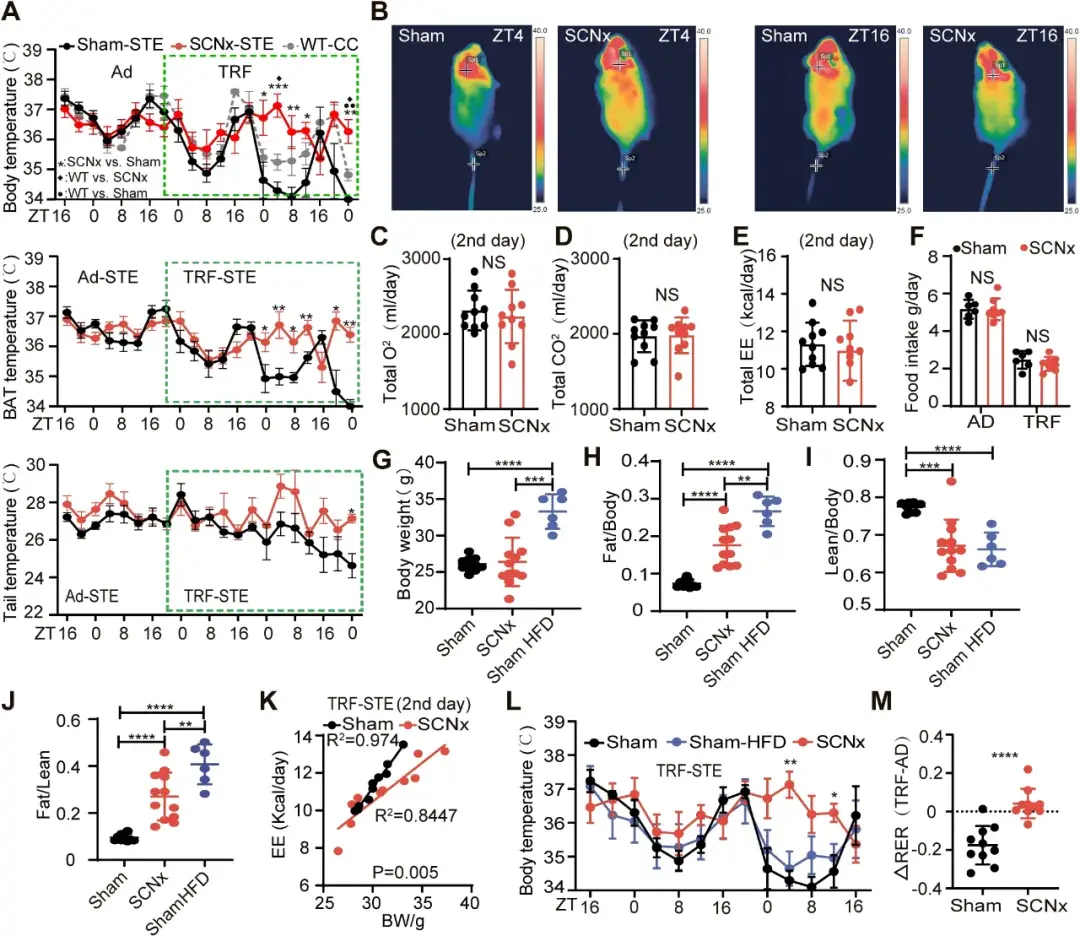
图1.SCNx抵抗TRF-STE诱导的低温
接下来,作者为了解SCNx小鼠体温维持的机制,评估了小鼠的代谢水平,发现SCNx小鼠脂肪分解、氧化被抑制,其BAT转向利用葡萄糖进行产热。表明在SCN破坏的情况下,葡萄糖选择性地重新分布到BAT,并且代谢发生转变,有利于葡萄糖作为产热燃料。
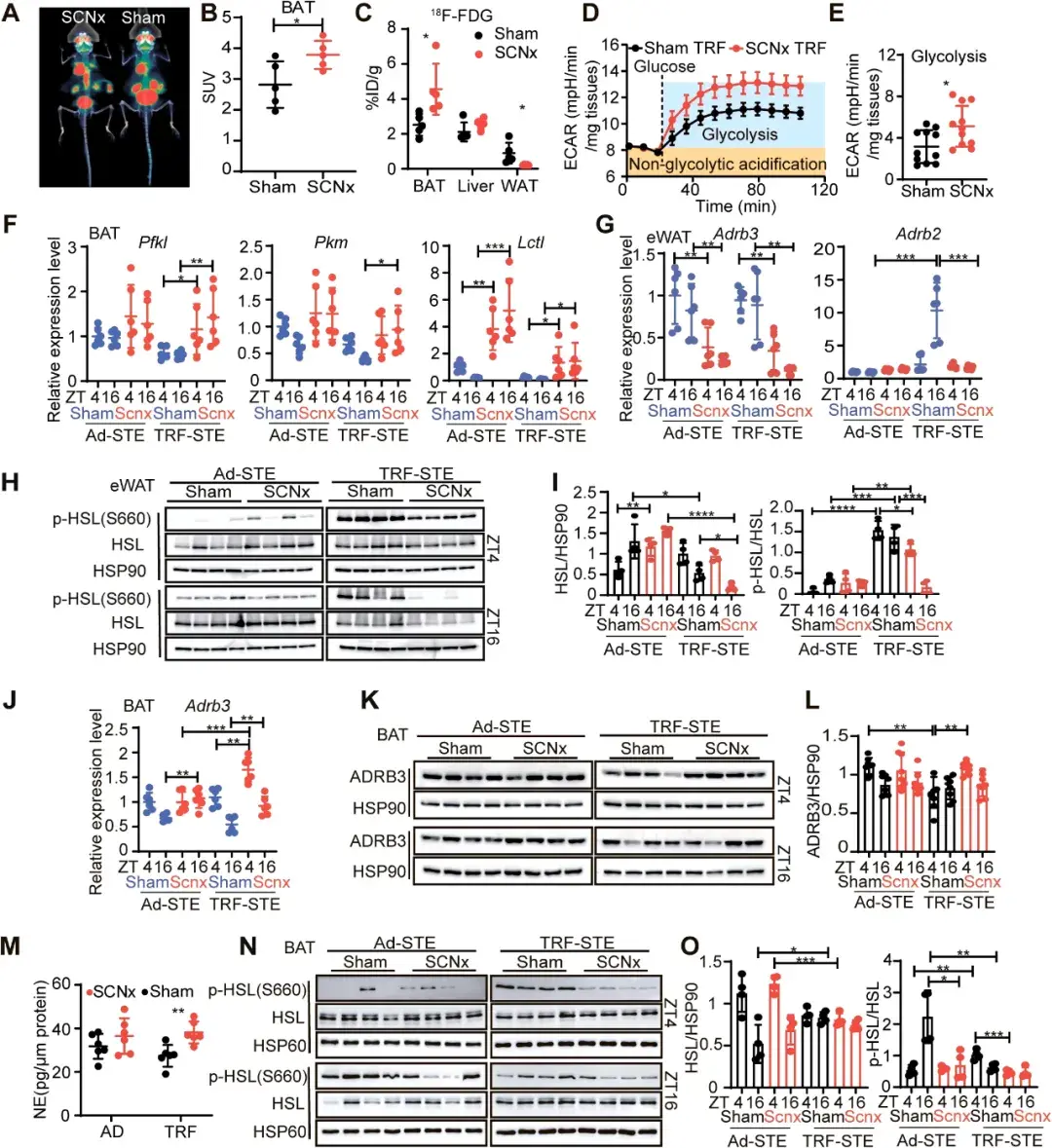
图2.SCN损伤会损害TRE-STE下的脂质动员和代谢灵活性
为了证明SCN介导BAT产热变化依赖于SNS,作者首先通过伪狂犬病毒(PRV)和单纯疱疹病毒(HSV)验证了SCN与BAT之间的解剖学联系。并通过破坏SNS和拮抗ADRB3,从功能上证明了TRF-STE下,SCN通过SNS调控BAT产热活性。
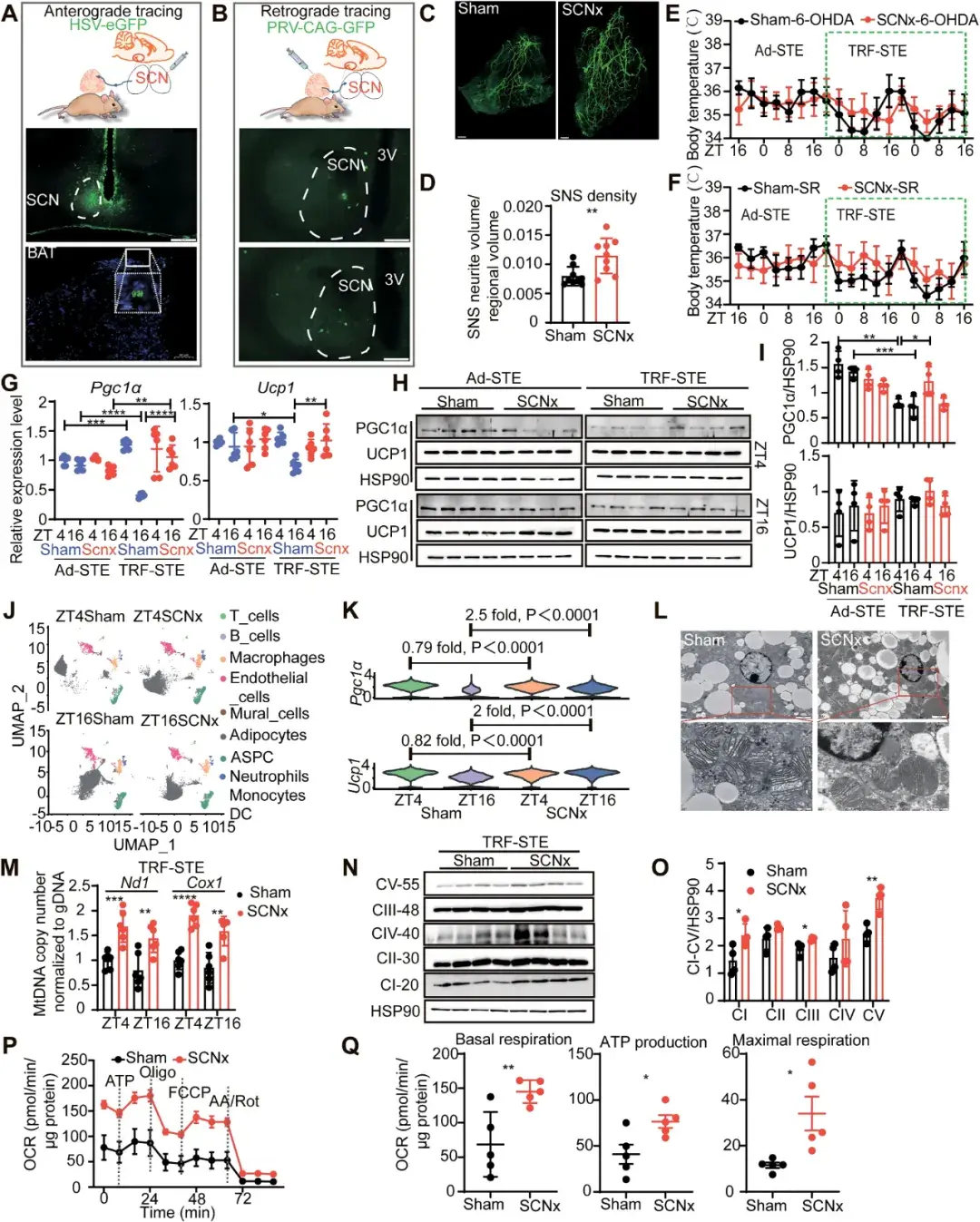
图3.SCN通过SNS调控BAT活性
为了探究SCN调控BAT的机制,作者进行了转录组测序。分析发现,sham小鼠在TRF-STE下脂肪祖细胞(ASPC)增殖被抑制,并且BAT出现生理学衰老。而SCNx小鼠抵抗了这一衰老,ASPC增殖得以继续。并且,作者通过体外实验发现,S100B可以促进ASPC的增殖与分化。
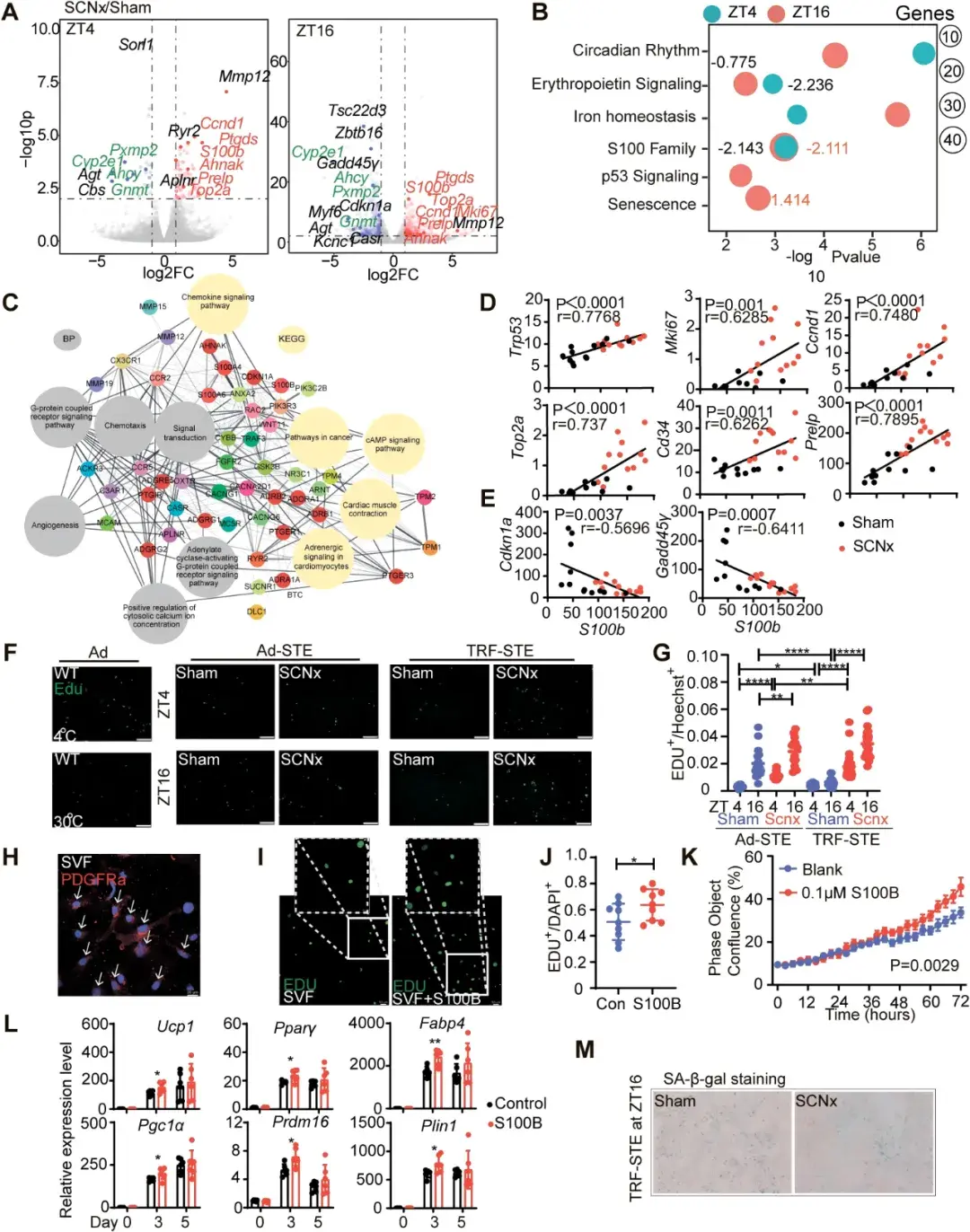
图4.SCNx抵抗TRF-STE诱导的BAT更新停滞
进一步探究发现,S100B对营养环境变化敏感,且在SCNx小鼠BAT中高表达。其表达受SCN-SNS-ADRB3调控,并且可以与ADRB3相互作用,放大β3-肾上.腺素能信号,并促进BAT的糖酵解活性。
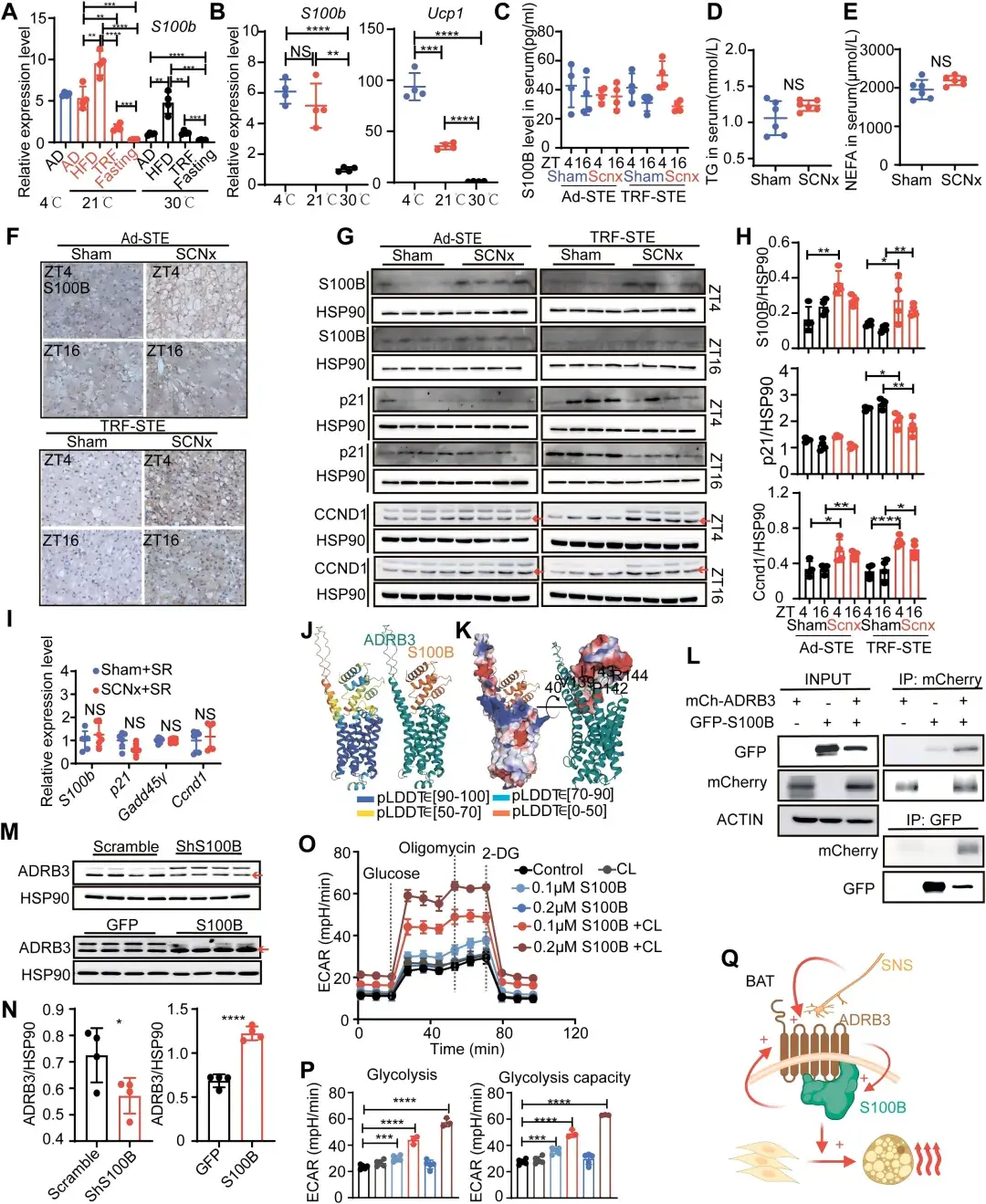
图5.S100B感知营养物质并放大β3-肾上.腺素能信号
为了明确S100B对BAT产热的重要性,作者通过腺相关病毒(AAV)在小鼠BAT中过表达以及敲降S100B。实验验证发现,SCNx小鼠BAT中S100B的缺失诱导小鼠出现低体温,而WT小鼠BAT中过表达S100B可以显著纠正低体温。证明了S100B对BAT产热的充分必要性。
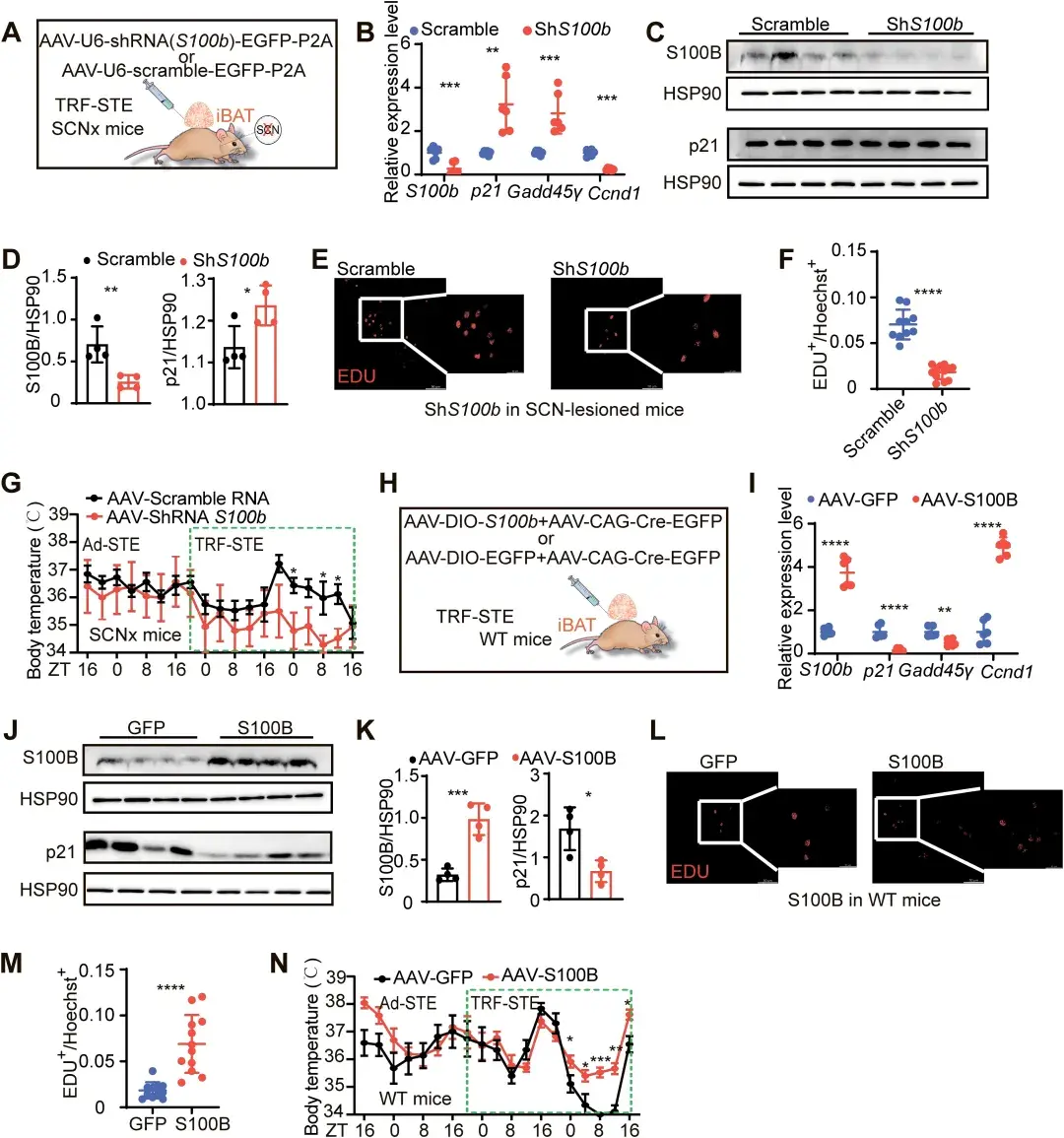
图6.S100B调控BAT产热的充分必要性
最后,作者通过构建不同SCNx小鼠模型,包括持续光照SCN功能紊乱,NMDA(N-甲基-D-天冬氨酸)诱导的兴奋性毒性以及Caspase3介导的GABA能神经元消融。发现均诱导小鼠在TRF-STE下的体温维持以及S100B表达。进一步证实了S100B激活是SCN多种破坏方式中保守的特征。
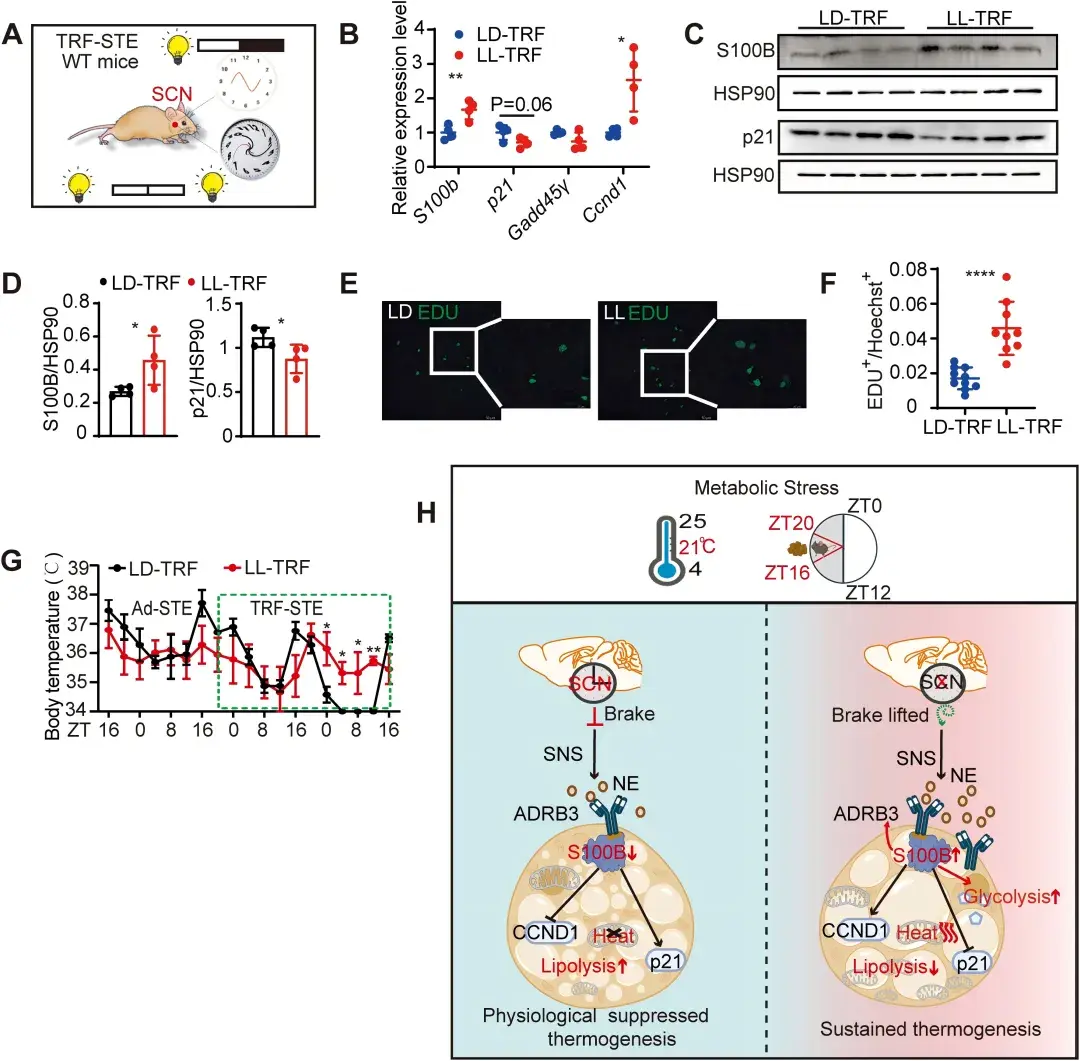
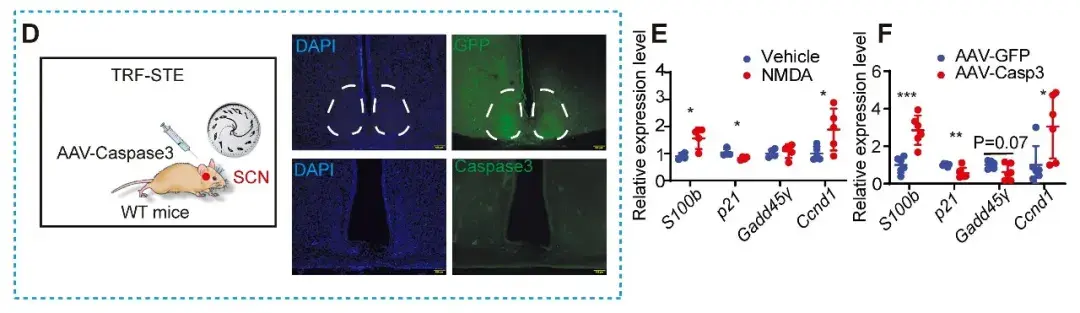
图7.TRF-STE下SCN功能障碍的多种互补模型
结论
该研究阐述了这样一个机制,在TRF-STE营养-温度双重压力模型中,功能完整的SCN通过抑制BAT交感神经通路的ADRB3信号活性,进而下调BAT中S100B的表达水平,S100B的低表达会直接导致ASPC增殖受阻,并促进BAT细胞启动衰老程序,最终使BAT产热程序关闭,以此实现机体能量的高效节约。而当SCN功能损毁后,小鼠可完全抵抗上述适应性调控模式。其BAT交感神经活性显著增强,神经末梢释放的NE(去甲肾上.腺素)显著增多,进而激活ADRB3信号通路,并进一步上调S100B的表达。高表达的S100B具备双重核心功能,不仅可显著促进ASPC增殖、抑制细胞衰老、维持BAT细胞更新能力,还能驱动BAT代谢模式重编程,使其转向葡萄糖依赖的产热模式。尤为关键的是,S100B可与ADRB3形成正向反馈调控环路,在脂质供应不足的条件下,进一步促进脂肪细胞的糖酵解进程,保障BAT持续稳定的产热输出。该调控机制的阐明,为理解中枢节律系统调控外周代谢适应的分子网络提供了全新的理论视角。
苏州大学博士生曾义准为论文第一作者,剑桥大学Antonio Vidal-Puig教授和苏州大学徐璎教授为论文的共同通讯作者。本研究得到了国家重点研发计划和国家自然科学基金的资助。
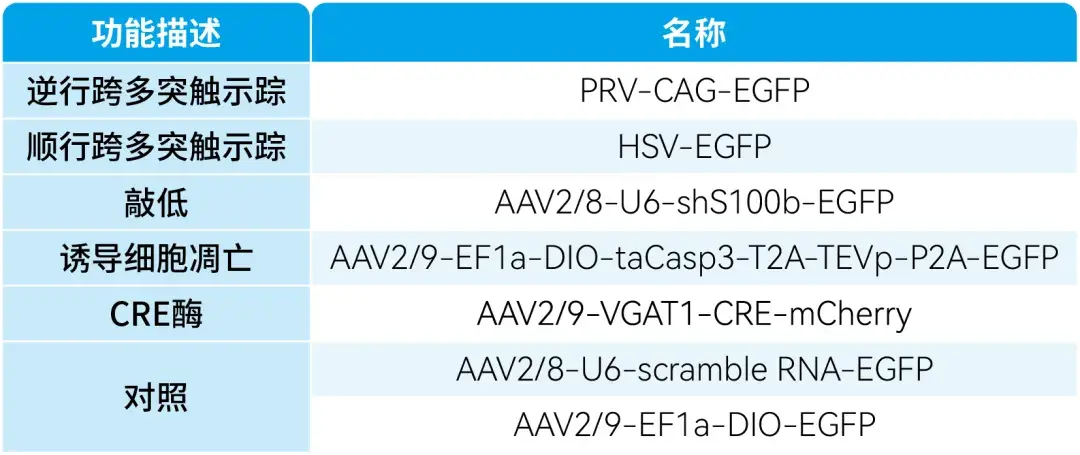
本文使用的来自枢密科技的病毒产品,列表如下:
如有相关需求,或了解更多产品服务,欢迎咨询我们!点击进入店铺,查看更多产品及服务