武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
IF=28.77【客户文章】情绪过山车:双相情感障碍|清华姚骏研究员团队揭示胰-脑反馈机制诱导小鼠抑郁相关行为的异常昼夜波动
73 人阅读发布时间:2025-09-22 09:49
约40%的双相情感障碍(BD)患者会出现糖尿病或胰岛素代谢综合征症状。临床研究表明,合并代谢障碍的BD患者往往病程慢性化、情绪循环更快,且对心境稳定剂的反应中等。胰腺β细胞胰岛素分泌受损是2型糖尿病(T2DM)和代谢综合征的关键特征之一,且有研究提示BD患者大脑中可能存在胰岛素不足。尽管临床研究提出了多种将代谢与BD关联的假说,包括胰岛素缺陷、葡萄糖氧化、神经炎症及遗传连锁等,但BD的发病机制以及双相行为与代谢异常共现的原因仍知之甚少。
胰岛素受体(InsR)广泛分布于多个脑区,包括海马和大脑皮层,这使得大脑对胰岛素信号敏感。在海马中,胰岛素功能障碍可诱发神经元萎缩,并参与海马相关的认知损伤和神经退行性变。除胰腺胰岛外,海马神经元也能分泌胰岛素,并通过中枢胰岛素通路调节海马功能。因此,外周和中枢的胰岛素释放都可能调节海马的生理功能。然而,海马神经元活动对胰腺胰岛及大脑中胰岛素分泌的影响尚不明确。
RORβ基因编码视黄酸相关孤儿受体β(RORβ,α/β/γ亚家族的转录因子),其可通过RevErb/ROR反应元件激活时钟基因Bmal1、Clock和Cry1。RORβ在感觉器官、胰腺和中枢神经系统中高表达,并在脑和视网膜发育中发挥作用。在人和小鼠的皮层中,RORβ富集于IV层神经元,提示其可能作为IV层的标记物。RORβ与BD和癫痫的易感性相关,且RORβ缺陷动物会出现昼夜节律或步态异常。尽管RORα在胰腺中表达最高,但RORβ和RORγ更可能参与胰岛相关疾病。不过,RORβ的生理意义仍不明确。
2025年8月11日,清华大学生命科学学院、清华-IDG/麦戈文脑科学研究院姚骏研究员课题组在Nature Neuroscience期刊(IF=28.771)在线发表了以“A pancreas-hippocampus feedback mechanism regulates circadian changes in depression-related behaviors”为题的研究论文。该研究探讨了胰腺RORβ和胰岛素分泌缺陷在BD中的作用。作者发现,BD患者的血浆和诱导多能干细胞(iPSC)衍生的胰岛样类器官中RORβ表达升高,而脑样本中无此现象,且这种上调会损害胰岛素分泌。利用CRISPR激活(CRISPRa)技术,特异性促进小鼠胰腺中RORβ的表达,会在光相诱发抑郁相关行为,在暗相诱发躁狂样行为。机制上,RORβ上调会在光相抑制胰岛素释放,导致海马过度活跃和抑郁样行为。这种海马过度活跃随后以延迟但持续的方式,在暗相触发胰岛素分泌过多,进而导致神经元活动减弱和躁狂样行为。这些效应通过电生理学、化学遗传学和光遗传学方法得到了证实。以上研究结果揭示了一种胰腺-海马反馈机制,通过该机制,代谢因素和昼夜节律因素共同作用,导致情绪障碍。

1.BD患者中RORβ的表达
研究人员通过仙台病毒将皮肤成纤维细胞重编程为iPSC,再将其诱导分化为类器官及神经元。实验分析发现:BD患者iPSC衍生的前脑类器官及海马齿状回(DG)神经元存在胰岛素信号传导缺陷,而其胰岛样类器官(含β细胞)则存在胰岛素分泌缺陷。
进一步研究显示,BD患者血浆及iPSC衍生的胰岛样类器官中,参与昼夜节律调控的转录因子RORβ表达显著升高;而BD患者iPSC衍生的前脑类器官、DG神经元及尸检前脑样本中,RORβ的表达则无明显异常。
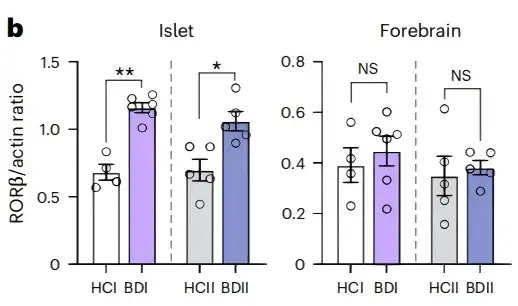
图1.BD患者iPSC衍生的胰岛样类器官中RORβ表达上调
2.RORβ激活小鼠的胰岛素释放及行为学研究
为探究胰腺中RORβ表达上调是否会影响神经精神相关行为,作者设计了一种基于腺相关病毒(AAV)的Cre/loxP条件性CRISPR激活系统[rAAV-EF1a-DIO-VP64-NLS-dSaCas9-U6-sgRNA(mRORβ),简写为rAAV-EF1a-DIO-CRISPRa-mRORβ;设计了两条向导RNA(sg1和sg2),以重复验证胰腺RORβ激活在Ins1CreERT小鼠中的功能],并将其静脉注射到他莫昔芬激活型Ins1CreERT小鼠体内。向一组同窝小鼠注射rAAV-EF1a-DIO-eGFP作为对照。腹腔注射他莫昔芬后,Cre重组酶可诱导胰岛β细胞特异性激活内源性RORβ基因。2周后,解剖GFP组小鼠,发现GFP仅在胰腺中表达。在与胰腺紧密相连的脾脏中观察到极弱的GFP荧光,但在其他受检器官中未检测到。对sg1/2组小鼠[注:sg1/sg2代表独立的小鼠组(sg1和sg2),而sg1/2代表两组合并为一组分析]的RORβ表达分析显示,与GFP对照组相比,sg1/2组小鼠胰腺中RORβ表达增强,而在包括大脑在内的其他器官中无此现象。此外,研究人员证实sg1/2组小鼠的大脑(皮层和海马)中也未检测到失活(d)Cas9。因此,这种基于AAV的条件性系统具有胰腺特异性表达的特点。
随后,作者监测了24小时内小鼠的基础及葡萄糖诱发的血浆胰岛素水平。结果显示,对照组小鼠的基础胰岛素峰值出现在光相,谷值出现在暗相;而sg1/2组小鼠的胰岛素峰值出现在暗相,谷值出现在光相。此外,光相中,sg1/2组小鼠的血浆胰岛素浓度及葡萄糖刺激胰岛素分泌(GSIS)能力低于对照组;但在暗相中,sg1/2组小鼠的胰岛素分泌水平更高。研究者还检测了sg1/2组小鼠海马中的胰岛素水平及胰岛素受体(InsR)磷酸化水平。由于脑组织的ELISA检测难度较大,采用蛋白质印迹法发现,与对照组相比,sg1/2组小鼠在血浆胰岛素峰值时海马中胰岛素水平及InsR磷酸化水平上调,而在谷值时下调。
接下来,作者通过强迫游泳实验(FST)和习得性无助(LH)实验评估小鼠的应激应对反应,并通过蔗糖偏好实验(SPT)和明暗箱(LDB)实验分别评估小鼠的快感缺失程度和焦虑水平。结果显示,光相中,与同窝GFP对照组小鼠相比,sg1和sg2组小鼠的LH逃避失败率增加、FST不动时间延长、蔗糖偏好率降低,且在LDB实验中光箱停留时间缩短。有趣的是,暗相中,与GFP对照组相比,sg1/sg2组小鼠的LH逃避失败率降低、FST不动时间缩短、蔗糖偏好率增加,这与啮齿动物模型中躁狂样行为的判定标准一致。在LDB实验中,sg1/sg2组小鼠在光箱的停留时间增加,表明焦虑样行为减轻。此外,还通过三箱社交(TCS)实验评估社交能力,发现在光相和暗相中,sg1/sg2组小鼠的社交互动未发生改变,但社交新颖性偏好受损。这些行为异常并非由运动功能缺陷引起。为明确行为表型是否由大脑中RORβ激活泄漏所致,研究人员向Ins1CreERT小鼠的双侧脑室注射rAAV-EF1a-DIO-CRISPRa-mRORβ,未在FST和SPT中观察到明显的行为异常。以rAAV-EF1a-DIO-eGFP作为荧光指示剂,也证实注射的病毒表达局限于脑室。此外,通过持续记录小鼠的转轮活动来监测sg1/2组小鼠的昼夜节律。结果显示,与对照组相比,sg1/2组小鼠的昼夜节律未发生改变,但转轮活动量及昼夜节律振幅均有所增加。总的来说,这些研究结果表明,胰腺中RORβ表达上调可导致小鼠抑郁相关行为的昼夜波动异常。
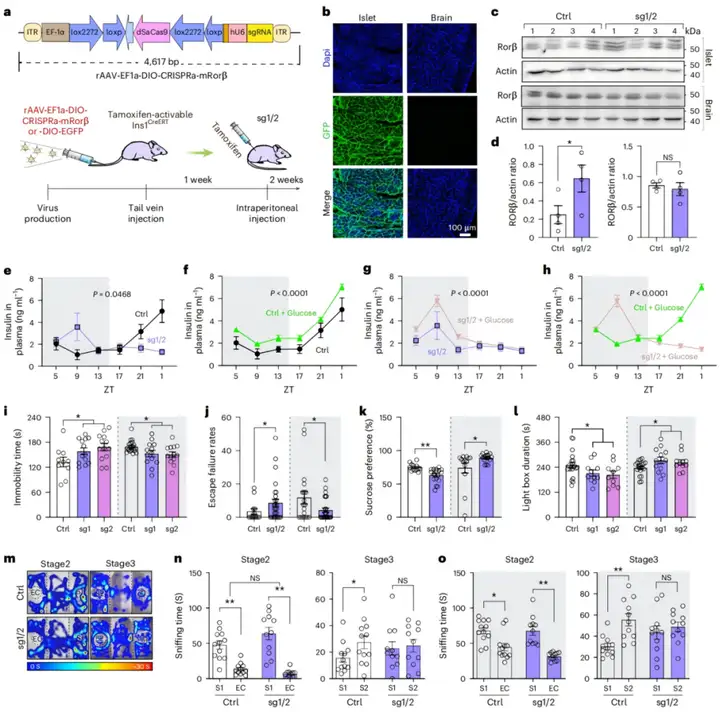
图2.胰腺中RORβ表达的激活诱导小鼠出现行为波动
3.胰岛素诱导的海马神经元放电变化对行为的影响
作者进一步研究发现,胰岛素可通过与脑内InsR结合调控小鼠行为;抑郁样行为表型可能是RORβ激活导致胰岛胰岛素分泌不足的结果。接下来,探究了sg1/2小鼠在暗相出现躁狂样行为异常的机制。为评估胰腺RORβ激活及胰岛素分泌不足对脑活动的影响,研究人员在光相分离sg1/2小鼠和对照小鼠的海马切片,对DG区域进行全细胞膜片钳记录。与对照组相比,sg1/2小鼠的神经元自发动作电位(AP)发放增强。用胰岛素孵育切片10分钟后发现,胰岛素降低了AP发放频率,并由此逆转sg1/2小鼠神经元的过度兴奋性。因此,胰岛素通过结合脑内InsR抑制神经元兴奋性。随后,在sg1/2小鼠海马中进行在体电生理记录,以分析神经元活动的昼夜模式。与对照组相比,sg1/2小鼠的AP具有不同的波形特征。主成分分析(PCA)证实,用于分析的神经元均具有个体特异性特征。对照组和sg1/2小鼠的自发放电均呈现明显的周期性模式:对照组的放电峰值出现在暗相,谷值出现在光相;反之,sg1/2小鼠呈现相反模式,峰值出现在光相,谷值出现在暗相。光相中,sg1/2小鼠的放电频率远高于对照组,这与胰岛素分泌减弱的结果一致;而暗相中,sg1/2小鼠的放电频率低于对照组,这与胰岛素释放增强的结果一致。综合来看,对照组和sg1/2小鼠的胰岛素节律或AP节律在时间上是相反的。
为验证海马活动异常是否对sg1/sg2小鼠的行为变化有快速影响,向DG区域注射rAAV-Cre以及化学遗传学工具AAV-DIO-hM3Dq或AAV-DIO-hM4Di,对照组注射rAAV-EF1a-DIO-eGFP。4周后,使用氯氮平-N-氧化物(CNO)激活hM3Dq/hM4Di,以增强或抑制海马神经元活动。CNO注射1.5小时后,对小鼠进行FST和LDB实验。结果显示,光相中,化学遗传学抑制海马活动消除了sg1/2小鼠增强的抑郁样行为;此外,暗相中,该处理消除了躁狂样行为表型。因此,这些研究结果表明,sg1/2小鼠的胰腺胰岛素分泌异常导致海马神经元放电模式异常,而这决定了它们的短期行为表型。
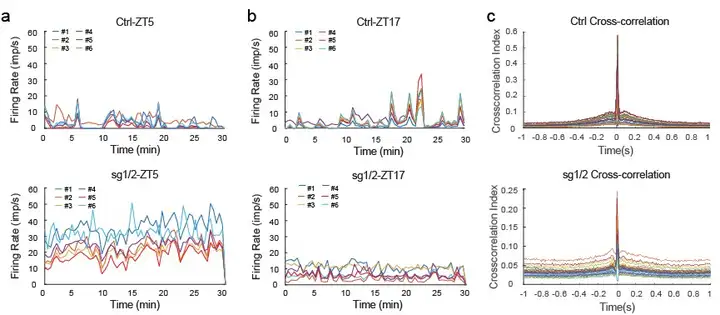
图3.sg1/sg2小鼠海马的在体电生理记录
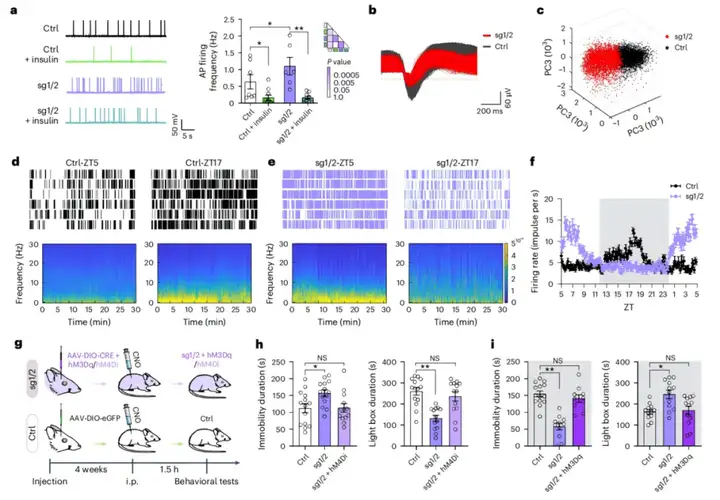
图4.sg1/2小鼠海马神经元活动的昼夜节律模式反转
4.海马对胰岛素和行为的长期反馈作用
为探究光相中海马过度活跃对胰腺胰岛素分泌的长期影响,采用光遗传学工具——融合了mCherry的视紫红质通道蛋白(ChR2)——来增强海马神经元活动。向小鼠腹侧海马(该区域调控抑郁和焦虑样行为)注射AAV-Syn-ChR2-mCherry。在对照小鼠中,在Zeitgeber时间(ZT)6-12(01:00-07:00)施加6小时光刺激(5 ms,10 Hz),以模拟sg1/2小鼠的神经元过度活跃状态。与未注射ChR2的组相比,光遗传学激活表达ChR2的对照小鼠升高了血浆胰岛素水平;值得注意的是,这种增强效应从刺激开始持续了12小时,且无明显细胞毒性。因此,这些结果表明,光相中海马过度活跃会诱导暗相中胰腺胰岛素分泌出现延迟且持续的增加。同时,在表达ChR2的sg1/2小鼠中,在ZT18-24(13:00-19:00)施加6小时光刺激,与未注射的sg1/2小鼠相比,也观察到胰岛素分泌的持续性增强,这表明逆转sg1/2小鼠暗相中海马活动低下减轻了其光相中的胰岛素分泌不足。
此外,采用融合了eGFP的盐细菌视紫红质(eNpHR3.0,简称NpHR)通过光遗传学抑制来减弱神经元活动,并向腹侧海马注射AAV-Syn-NpHR-eGFP。在对照组中,对表达NpHR的小鼠在暗相(ZT18-24)进行6小时光遗传学抑制,会诱导光相中胰腺胰岛素分泌出现持续性减少。在表达NpHR的sg1/2小鼠中,在光相(ZT6-12)进行6小时光遗传学抑制,也会导致暗相胰岛素释放出现类似的长期减弱。所有这些结果表明,sg1/2小鼠的神经元放电模式可能对胰岛分泌存在长期反馈影响;此外,sg1/2小鼠暗相中胰岛素释放增加,至少部分是由光相中海马过度活跃的反馈作用诱导的。
最后,作者探究了通过光遗传学调控海马神经元活动来改变胰岛素释放的结果。蛋白质印迹分析显示,光遗传学刺激6小时后,ChR2激活仍会上调对照小鼠和sg1/2小鼠海马中的InsR磷酸化水平,而NpHR抑制则会下调该水平。同时,行为学分析显示,光遗传学刺激6小时后,ChR2激活的对照小鼠和sg1/2小鼠均表现出FST不动时间减少,以及LDB实验光箱停留时间增加。与之相对,NpHR抑制的小鼠表现出相反的行为结果。因此,上述结果可能表明,海马中InsR磷酸化水平与小鼠行为之间存在相关性。综上,这些结果显示,在sg1/2小鼠中,光相中的胰腺胰岛素分泌不足会诱导海马神经元过度活跃,这会产生两种效应:一是短期效应,诱导抑郁样行为;二是延迟但持续的效应,逐渐促进暗相中的胰岛素分泌,从而逆转海马神经元活动和行为表型。
此外,研究人员尝试检测可能参与sg1/2小鼠行为调控的海马相关神经环路。向腹侧CA1区(vCA1)注射AAV-hSyn-mCherry,观察到外侧下丘脑区(LHA)中出现mCherry信号。已有研究表明,vCA1-LHA投射参与焦虑样行为的调控。为验证vCA1-LHA投射在sg1/2小鼠行为中的作用,向LHA注射retroAAV-hSyn-eGFP-Cre,并向vCA1注射rAAV-EF1a-DIO-hM4Di-mCherry。观察到vCA1中存在mCherry表达,且其延伸至LHA。在光相中用CNO抑制vCA1活动后,发现sg1/2小鼠的抑郁样行为异常得到缓解。因此,vCA1-LHA投射可能是参与sg1/2小鼠海马依赖性行为表型调控的神经环路之一。
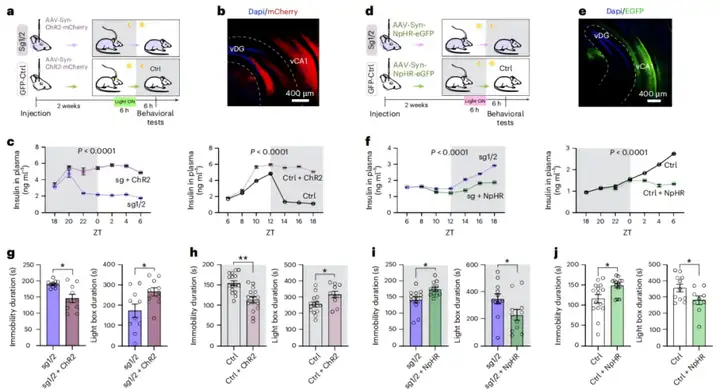
图5.海马对胰腺的长期反馈诱导胰岛素与行为的反转
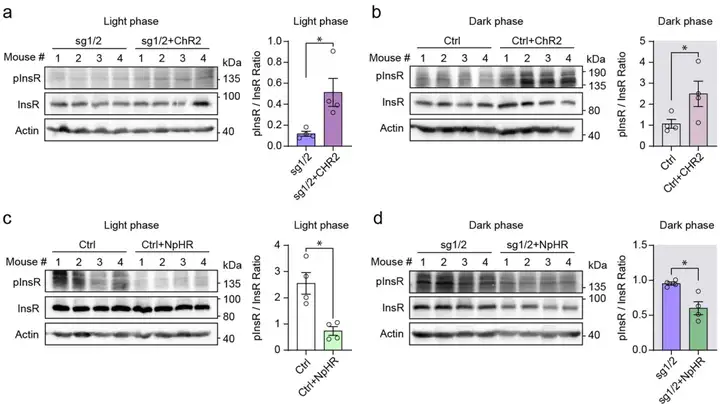
图6.光刺激对InsR磷酸化的长期效应
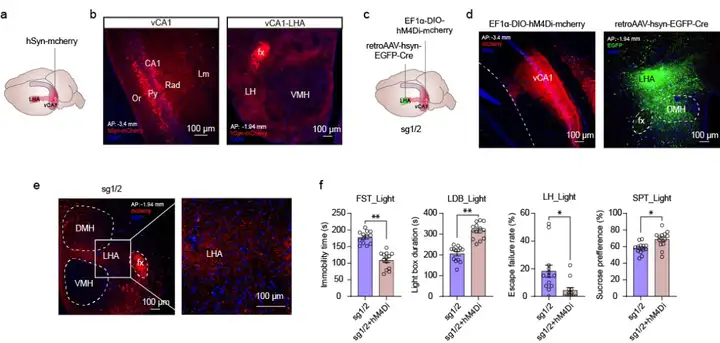
图7.vCA1-LHA投射参与调控sg1/2小鼠的行为异常
总结
本研究提供了证据,证实存在一种由胰岛RORβ表达上调驱动的胰-脑反馈机制,该机制可诱导小鼠抑郁相关行为的异常昼夜波动。作者推测其机制如下:(1)胰岛中RORβ表达上调减少光相胰岛素分泌;(2)胰岛素分泌不足增加海马神经元活动;(3)光相海马过度活跃诱导抑郁样行为,并产生延迟的反馈效应,促进暗相胰岛素释放;(4)暗相胰岛素分泌过多降低海马活动,诱导躁狂样行为。此外,sg1/2小鼠暗相海马活动低下会减弱海马对光相胰岛素分泌的驱动作用。
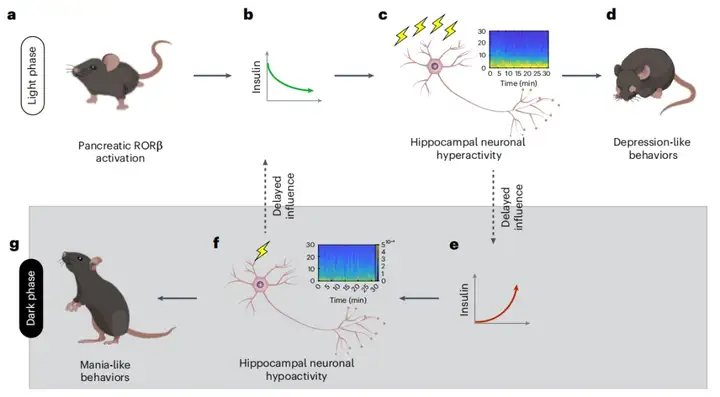
图8.通过胰腺-海马反馈机制诱导sg1/sg2小鼠行为昼夜波动的示意图
清华大学生命科学学院研究员姚骏为论文通讯作者,生命科学学院已出站博士后刘要南博士、美国索尔克生物研究所王秋文博士、生命科学学院2020级博士生佘心宇、首都医科大学附属天坛医院副主任医师李丽君为论文共同第一作者。
✦ 通讯作者介绍
姚骏,博士,研究员,副教授。该课题组致力于从遗传学、分子和神经环路等多个维度阐明情感障碍(BD和抑郁症)的发病机理。情感障碍是发病率、遗传率和自杀率最高的一类疾病,但目前这类疾病的发病机理仍不清楚,临床药物也存在很多限制和副作用。课题组的研究主要基于iPSC、3D类脑和小鼠模型,采用膜片钳和在体电生理、超高分辨率显微成像、动物行为学、光遗传、冷冻电镜以及多种基因测序手段,从病人iPSC分化的神经元和3D类脑中遴选出疑似与发病相关的关键基因或分子通路,结合类脑和小鼠模型,探究:1)该通路导致疾病发生的分子水平机理;2)其产生致病影响的小鼠关键脑区和神经环路;3)在人类神经元中受不同易感基因调控的遗传学机制。
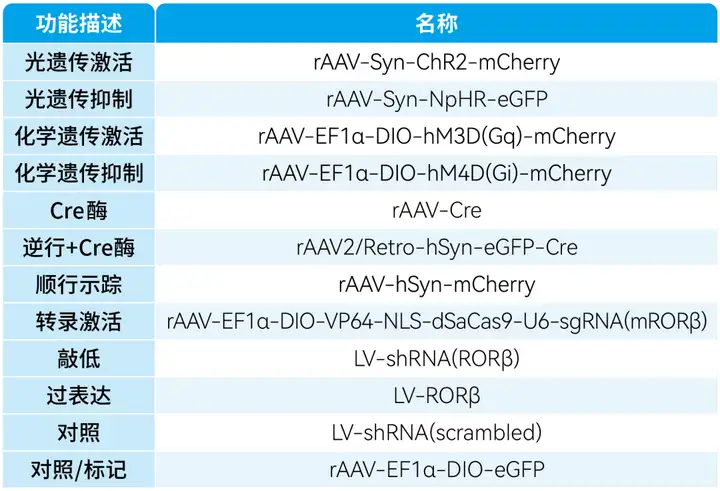
本文使用的病毒产品,列表如下:
如有相关需求,或了解更多产品服务,欢迎咨询我们!点击进入店铺,查看更多产品及服务