武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【客户文章】Sci Adv:天津医科大学谌辉教授团队揭示急性睡眠剥夺缓解抑郁的局部神经环路和分子机制
459 人阅读发布时间:2025-09-22 09:36
睡眠是人体生命活动中一个至关重要的组成部分,主要可分为两个阶段:快速眼动(REM)睡眠和非快速眼动(NREM)睡眠。在REM睡眠期间,大脑清除代谢废物的能力会下降,而这一过程也可能受到睡眠剥夺(SD)的干扰。睡眠剥夺本身被认为是一种快速起效的抗抑郁手段,能够在短时间内对许多抑郁症患者产生积极响应。正因如此,REM睡眠剥夺成为一种理想的实验范式,可用于增强锥体神经元的突触可塑性,进而缓解抑郁。该研究旨在探讨睡眠剥夺缓解抑郁的潜在环路和分子机制,为新型高效的快速抗抑郁药物的研制提供新思路。
2025年9月10日,天津医科大学基础医学院谌辉教授课题组在Science Advances期刊(IF=12.5)在线发表了题为“Acute REM sleep deprivation alleviated depression-like behavior mediated by inhibiting VIP neurons in the mPFC”的研究论文。在这项研究中,研究人员通过慢性不可预知温和应激(CUMS)成功构建了抑郁小鼠模型,并结合化学遗传学操控、光纤钙信号记录、Western blot、高尔基染色、场电位记录及神经递质荧光探针等多种技术方法,明确了内侧前额叶皮层(mPFC)中血管活性肠肽(VIP)神经元→锥体神经元(通过VIP2型受体/VPAC2)→腺苷酸环化酶(AC)/环磷酸腺苷(cAMP)/蛋白激酶 A(PKA)信号通路这一分子与细胞机制在急性睡眠剥夺缓解抑郁中的关键作用。

研究先对雄性C57BL/6J小鼠采用CUMS构建抑郁样模型,次日让其经历12小时REM SD后开展行为学测试。旷场实验(OFT)显示,CUMS会减少小鼠在旷场中央区域的移动距离,而REM SD可缓解该情况;相比CUMS组,REM SD还能缩短小鼠在悬尾实验(TST)和强迫游泳实验(FST)中的不动时间,提高蔗糖偏好实验(SPT)中的蔗糖偏好度。后续对雌性抑郁小鼠的研究发现,REM SD也能缓解其抑郁样行为,与雄性小鼠结果一致。此外,6小时REM SD或18小时REM SD可引起小鼠焦虑样行为,但12小时REM SD并不会引起焦虑样行为。
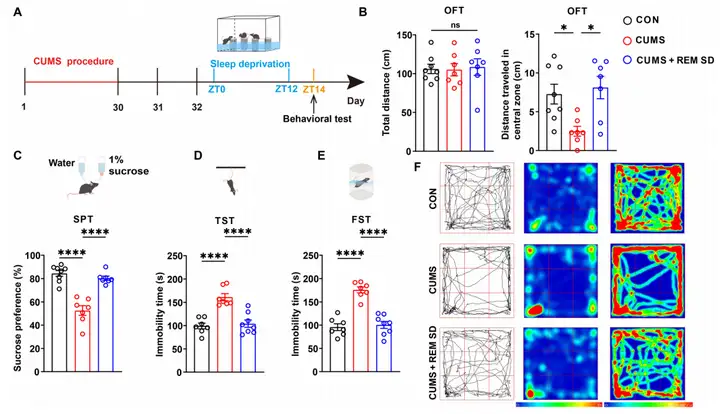
图1.12小时REM SD缓解抑郁样行为
研究通过高尔基染色发现,CUMS抑郁模型小鼠mPFC的树突复杂性、树突棘密度、蘑菇状树突棘比例及细长状树突棘比例均降低,短粗状树突棘比例升高,而REM SD可逆转上述结构改变,表明mPFC的突触可塑性得到增强。18小时REM SD显著增强突触可塑性,6小时REM SD对突触可塑性的影响有限,且12小时REM SD对正常小鼠突触可塑性无影响。REM SD还可恢复前扣带回皮层和海马CA1区的树突结构。分子机制上,REM SD逆转了CUMS组小鼠mPFC内AMPA受体亚基——谷氨酸受体1(GluA1)及其磷酸化形式(p-GluA1)的表达下调,并纠正谷氨酸受体2磷酸化水平(p-GluA2)的异常升高。此外,在经REM SD处理的小鼠mPFC中,θ脉冲刺激(TBS)可诱导产生突触依赖性长时程增强(LTP),表明REM SD能增强功能性突触可塑性。综合来看,REM SD通过调控AMPA受体磷酸化与突触可塑性,多层面改善抑郁相关的突触功能障碍。
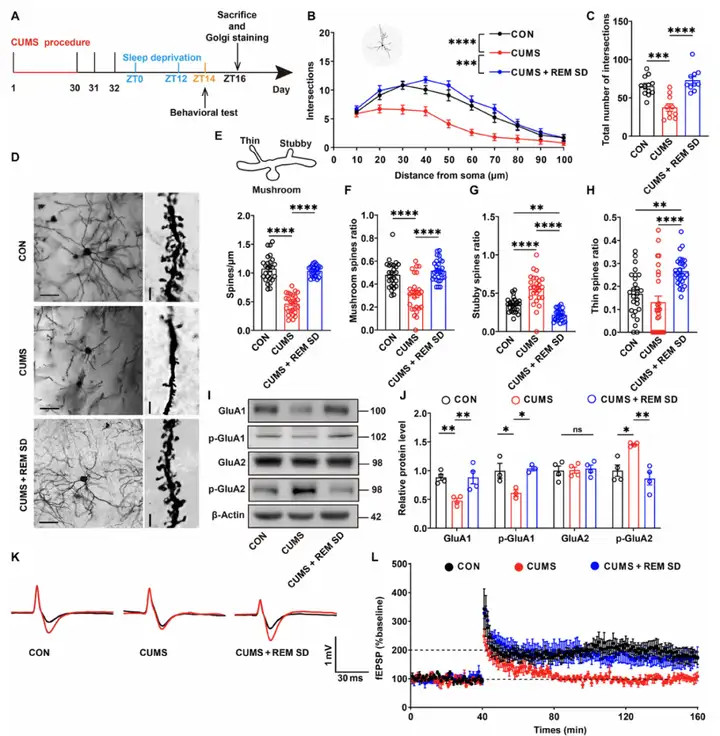
图2.REM SD后突触可塑性的恢复
随后通过光纤光度法检测小鼠mPFC中锥体神经元、生长抑素(SST)神经元和VIP神经元在TST中的钙信号活动。结果显示,CUMS抑郁模型下锥体神经元和SST神经元活动降低,而VIP神经元活动显著上升;经过REM SD干预后,三者活动均恢复至正常水平。免疫荧光染色检测c-fos蛋白表达进一步验证该结果。鉴于VIP神经元可通过抑制其他抑制性神经元间接调控锥体细胞,作者重点探讨VIP神经元在抑郁缓解过程中的作用机制。
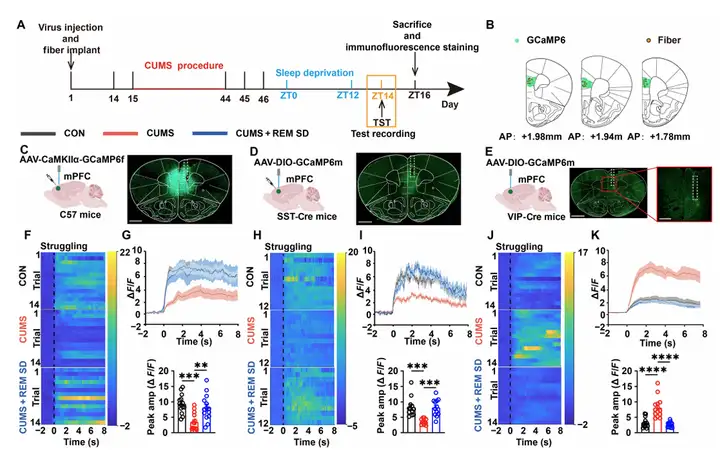
图3.在TST中的挣扎行为期间,不同类型的mPFC神经元被激活情况
作者为了进一步探究REM SD缓解抑郁的机制,本研究利用化学遗传学技术(DREADDs)分别激活或抑制mPFC的VIP神经元和SST神经元。结果显示,在REM SD后激活VIP神经元可使小鼠重新出现抑郁样行为,而抑制抑郁状态下的VIP神经元则显著缓解抑郁样行为。相比之下,激活抑郁状态下的SST神经元仅减少FST中的不动时间,抑制REM SD后的SST神经元则无明显行为学改善。研究结果提示,mPFC中VIP神经元而非SST神经元的活性在REM SD缓解抑郁中起关键作用。
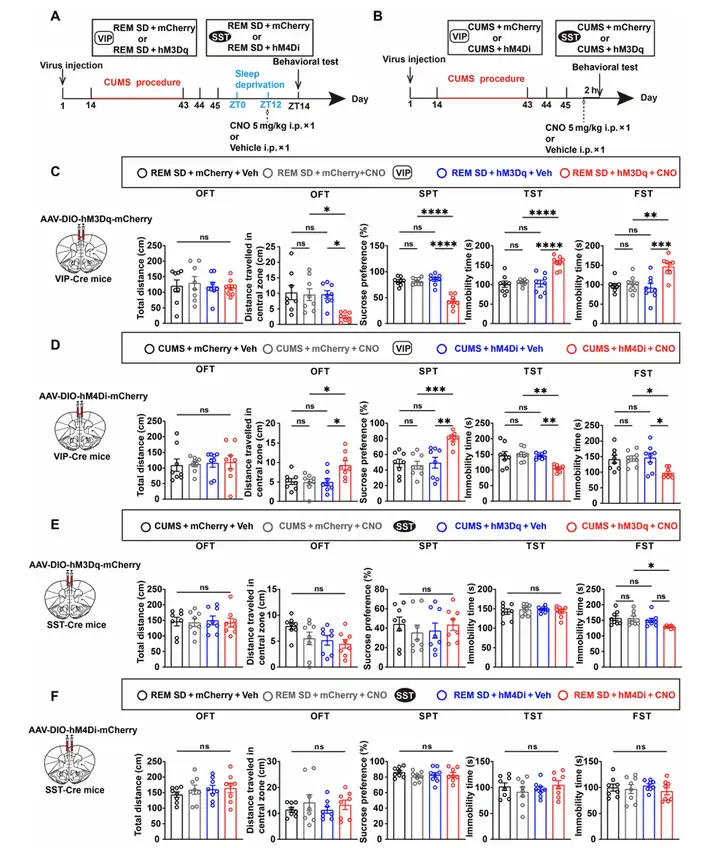
图4.化学遗传学抑制VIP神经元可阻止抑郁样表型的出现
为了探究mPFC中VIP神经元如何影响该脑区的局部微环路,作者采用GRAB神经递质探针结合化学遗传学调控的方法。结果显示,化学遗传抑制抑郁小鼠的VIP神经元可增强谷氨酸(GRABglu信号)和生长抑素(GRABsst信号)的释放,而激活REM SD后的VIP神经元则显著降低这两种神经递质的水平。该调控效应在雌雄小鼠中一致。结果表明,REM SD的缓解抑郁特性依赖于mPFC中的VIP神经元。
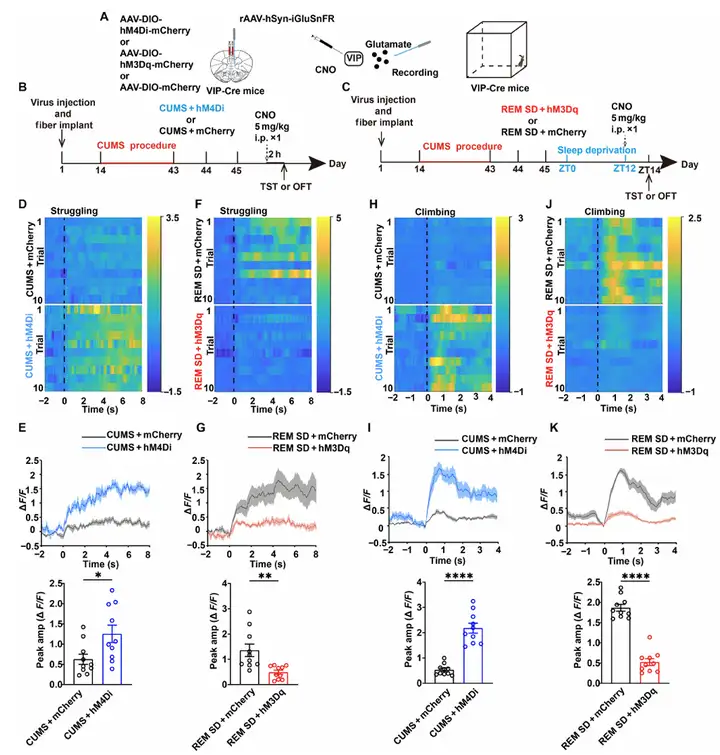
图5.在TST和OFT中,化学遗传学调控VIP神经元影响谷氨酸信号传递
为了探究REM SD缓解抑郁的内在分子机制,即VIP相关高亲和力受体(VPAC1或VPAC2)在其中的作用。作者首先采用Western blot技术,发现CUMS升高mPFC中VPAC2表达,而REM SD使其恢复正常;VPAC1无变化。随后,利用shRNA特异性敲低锥体神经元上VPAC2后,REM SD的抗抑郁效应被阻断,AC/cAMP/PKA信号通路活性降低,p-GluA1表达下降且p-GluA2上升,树突棘密度减少,抑郁行为重新出现。在SST神经元中敲低VPAC2则无显著行为影响。结果表明,VPAC2是REM SD缓解抑郁的关键分子靶点。
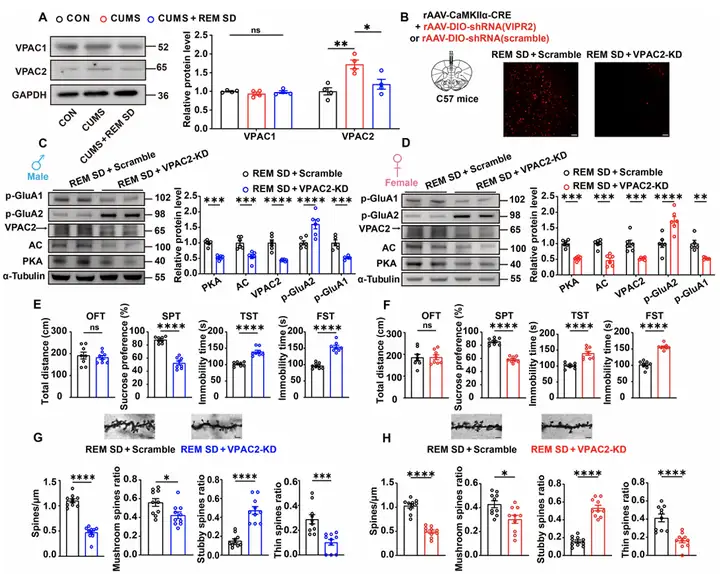
图6.VIP神经元调节位于锥体神经元上的VPAC2受体,而VPAC2是REM SD缓解抑郁的主要靶标
结论
综上所述,该研究结合光纤光度、化学遗传学、免疫荧光、GRAB荧光探针和Western blot等技术,解析了REM SD通过抑制mPFC中VIP神经元活动、调控VPAC2受体及其下游AC/cAMP/PKA信号通路以缓解抑郁样行为的神经机制(图7),深化了对睡眠干预抗抑郁作用环路和分子基础的认识,为开发快速起效的抗抑郁策略提供了新的潜在靶点。
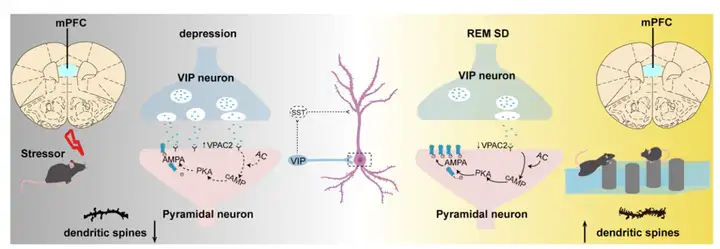
图7.REM SD通过抑制mPFC中VIP神经元缓解抑郁的机制图
天津医科大学硕士生朱昱萱、博士生吴桐瑞和天津市安定医院主任医师焦清艳为论文的共同第一作者,谌辉教授为论文的唯—通讯作者。该项工作得到了科技部2030重大项目、国家自然科学基金的大力支持。

通讯作者介绍:
谌辉,教授,主任医师,博士生导师,基础医学院细胞生物学系。长期从事神经科学研究,应用先进的双光子荧光显微镜、神经电生理、转基因、神经示踪、光遗传、化学遗传、光纤光度、分子生物学以及行为学等技术,探讨兴奋性和抑制性神经递质受体以及神经环路在神经及精神性疾病发病中作用机制。获得中国国家脑计划、国家自然科学基金重大项目及面上项目、天津市特殊人才计划资助。曾获国家科学技术进步二等奖、湖北省科学技术进步一等奖。在Science、Nature Neuroscience、Science Advances等期刊发表研究论文50多篇,其中Nature Neuroscience为封面论文,同期刊发评论文章,世界主要新闻媒体包括我国新华社和中国日报都报道了研究成果。
本文使用的来自枢密科技的病毒产品,列表如下:

如有相关需求,或了解更多产品服务,欢迎咨询我们!点击进入店铺,查看更多产品及服务