武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【客户文章】下丘脑室旁核参与胰腺癌内脏痛的神经调控机制—上海交通大学医学院附属第九人民医院夏明教授团队揭示
1555 人阅读发布时间:2024-01-25 13:14
胰腺癌引起的慢性内脏痛是临床上常见的疼痛类型。腹痛在胰腺癌患者中普遍存在,且晚期疼痛的发生率高达90%。胰腺癌是一种侵袭性高、预后差的恶性肿瘤,在全球最常见的癌症中排名第11位。2015年我国约有9万例胰腺癌新发病例,居世界第9位。胰腺癌引起的内脏疼痛不仅给社会和家庭造成严重的经济负担,也严重影响人们的生活质量。然而,胰腺癌内脏痛的中枢机制尚不明确,导致胰腺癌内脏痛尚无特.效的治疗方法。因此,胰腺癌内脏痛的神经调节机制亟待探索。
2024年1月24日,上海交通大学医学院附属第九人民医院夏明教授/姜虹教授课题组联合中日友好医院疼痛科樊碧发教授课题组于《Hepatobiliary Surgery and Nutrition》期刊(影响因子8.0)在线发表了题为“Glutamatergic neurons in the paraventricular nucleus of the hypothalamus participate in the regulation of visceral pain induced by pancreatic cancer in mice”的研究论文。在这项工作中,研究人员通过胰腺原位注射胰腺癌细胞成功建立了胰腺癌内脏痛小鼠动物模型,结合光学成像、c-fos共标记法、化学遗传、钙成像、脑片电生理等技术和对胰腺癌内脏痛的形态、行为、生理和病理的评估,明确了下丘脑室旁核PVN中谷氨酸能神经元参与调控胰腺癌诱发小鼠内脏痛的过程,该发现为寻求治疗胰腺癌内脏痛的有效靶点提供了新思路。

通过胰腺注射mPAKPC-luc细胞的方法建立了C57BL/6N小鼠胰腺癌内脏痛的模型。为评估小鼠内脏痛程度,作者利用Von Frey纤维丝垂直刺激左上腹进行腹部机械性痛觉敏感测试并观察弓背状态进行评分。发现在小鼠胰腺注射mPAKPC-luc细胞后12天,腹部机械性痛觉敏感表现出显著性差异(图1B),但弓背评分无显著性差异(图1C)。注射mPAKPC-luc细胞后15天,腹部机械性痛觉敏感(图1D)和弓背评分(图1E)均表现出显著性差异。注射mPAKPC-luc细胞后18天,腹部机械性痛觉敏感(图1F)和弓背评分(图1G)均表现出显著性差异,且平均差异呈现进一步扩大。行为学测评结果表明,小鼠胰腺癌内脏痛模型建立成功。
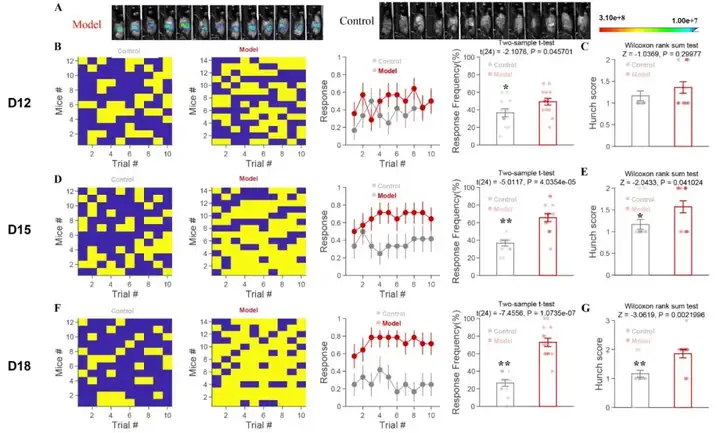
图1 胰腺癌内脏痛模型的建立
为鉴定调控胰腺的脑区,作者在小鼠胰腺注射PRV-EGFP的神经示踪病毒载体,随后对脑组织进行切片成像,结果显示,PVN中有大量EGFP标记的神经元(图2),提示PVN脑区参与胰腺的神经调控。此外,作者还观察到PRV标记到的脑区包括初级体感皮层、初级运动皮层、次级运动皮层、下丘脑背内侧核、下丘脑外侧区、中缝背核、中脑导水管周围灰质、丘脑背外侧核。
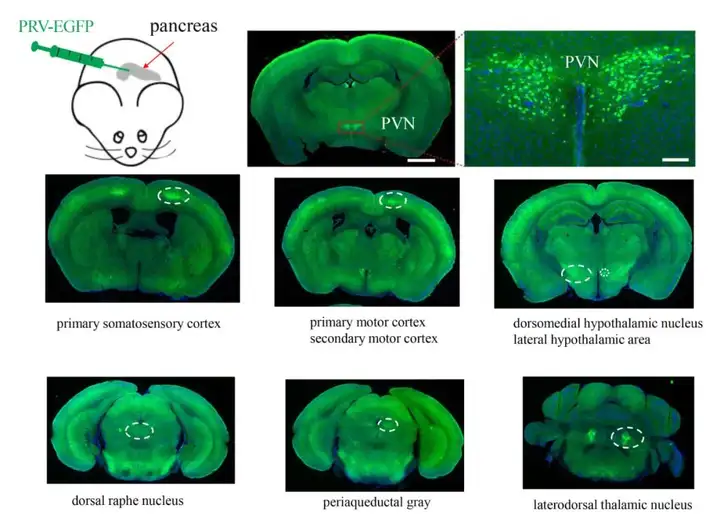
图2 胰腺感染PRV-EGFP后脑组织荧光成像
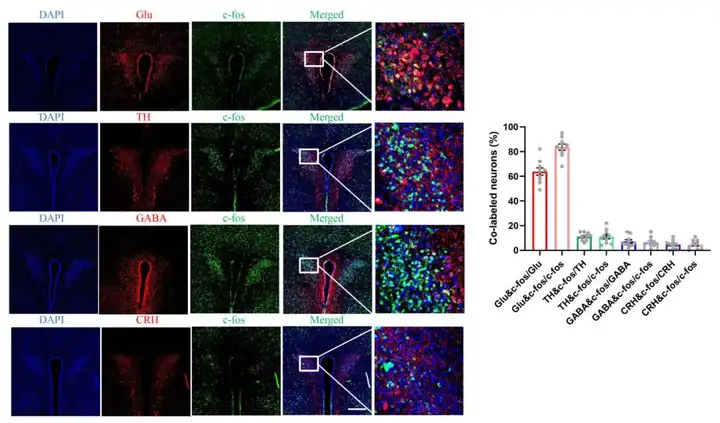
为进一步揭示PVN脑区中调控胰腺癌内脏痛的神经元种类,作者采用了c-fos和神经元marker共标的免疫荧光技术确定激活神经元的类型。结果显示,超过80%的c-fos阳性神经元与谷氨酸能神经元共标记,与GABA神经元、CRH神经元、TH神经元共标记较少(图3)。因此,作者推测PVN脑区谷氨酸能神经元在内脏痛的调控中起重要作用。后续的实验围绕PVN脑区谷氨酸能神经元活性对内脏痛的调控作用机制进行开展。
通过离体脑片膜片钳检测假手术和模型组中PVN脑区谷氨酸能神经元的电生理特性。图4A为对照小鼠和模型小鼠PVN脑区中谷氨酸能神经元动作电位发放的典型图。此外,研究人员发现胰腺癌疼痛模型小鼠PVN脑区谷氨酸能神经元的动作电位频率、静息膜电位(RMP)均增加(图4B,4C),两组阈值无显著性差异(图4D)。这些结果表明胰腺癌引起的疼痛导致PVN脑区谷氨酸能神经元的过度活跃。
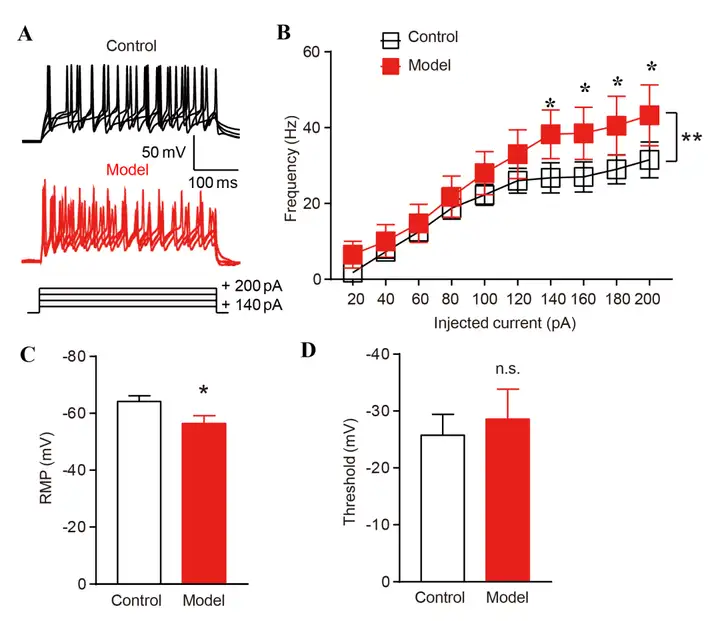
图4 胰腺癌疼痛诱导PVN谷氨酸能神经元过度活跃
利用光纤记录钙成像技术进一步检测PVN脑区谷氨酸能神经元钙活动与胰腺癌疼痛之间的关系。结果发现,胰腺癌痛显著增强PVN脑区谷氨酸能神经元的钙活性(图5A,5B)。此外,在刺激0-2、0-3、0-4、0-5s后,研究人员量化统计了平均钙活性和峰值钙活性的数据。结果发现,在刺激后PVN脑区谷氨酸能神经元的平均钙活性和峰值钙活性均增强(图5C,5D)。
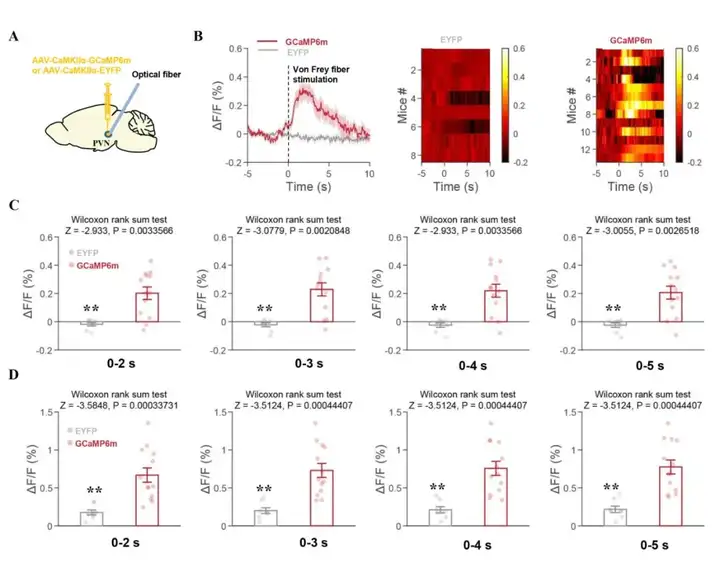
图5 胰腺癌疼痛增强PVN谷氨酸能神经元的钙活性
为验证特异性消融PVN脑区谷氨酸能神经元可减轻胰腺癌引起的内脏痛。作者利用taCasp3-TEVp诱导PVN中的谷氨酸能神经元的凋亡;小鼠注射病毒20天后,其谷氨酸能神经元细胞平均损失86.2%(图6A,6B)。于注射病毒后14、17、20天,采用腹部机械性痛觉敏感测试试验和弓背评分评估内脏痛;小鼠注射病毒后14日,腹部机械性痛觉敏感表现出显著性差异(图6C),但弓背评分无显著差异(图6D)。同样,在小鼠注射病毒后17日,腹部机械性痛觉敏表现出显著性差异(图6E),但弓背评分无显著差异(图6F)。在注射病毒后20天,腹部机械性痛觉敏感(图6G)和弓背评分(图6H)均无显著性差异。行为学评估结果表明靶向消融PVN脑区谷氨酸能神经元可部分缓解胰腺癌诱发的内脏痛。
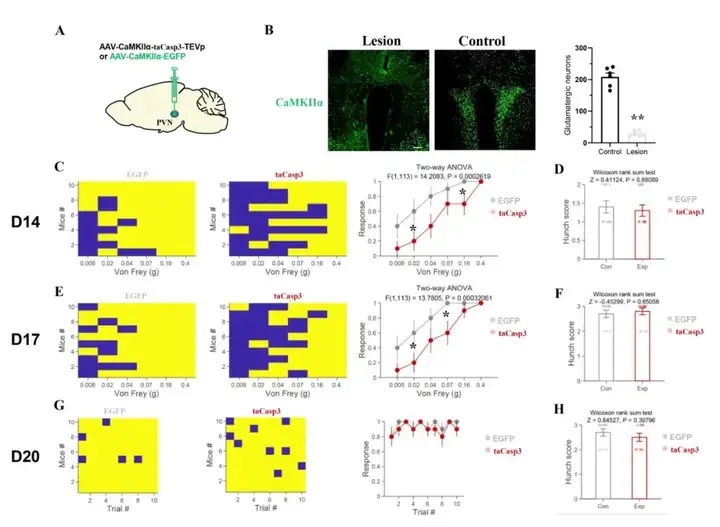
图6 特异性消融PVN谷氨酸能神经元可缓解胰腺癌诱发的内脏痛
同样,作者使用化学遗传学方法特异性抑制PVN脑区谷氨酸能神经元的活性,以探索它们在胰腺癌内脏痛中的作用。于注射病毒后14、17、20天,采用腹部机械性痛觉敏感试验和弓背评分评估内脏痛;在小鼠注射病毒后14日,腹部机械性痛觉敏感实验结果表现出显著性差异(图7C),但弓背评分无显著差异(图7D)。小鼠注射病毒后17天,腹部机械性痛觉敏感测试(图7E)和弓背评分(图7F)均存在显著性差异。在注射病毒后20天,腹部机械性痛觉敏感(图7G)和弓背评分(图7H)均无显著差异。行为学测试结果表明,特异性抑制PVN谷氨酸能神经元活性可缓解胰腺癌引起的内脏痛。
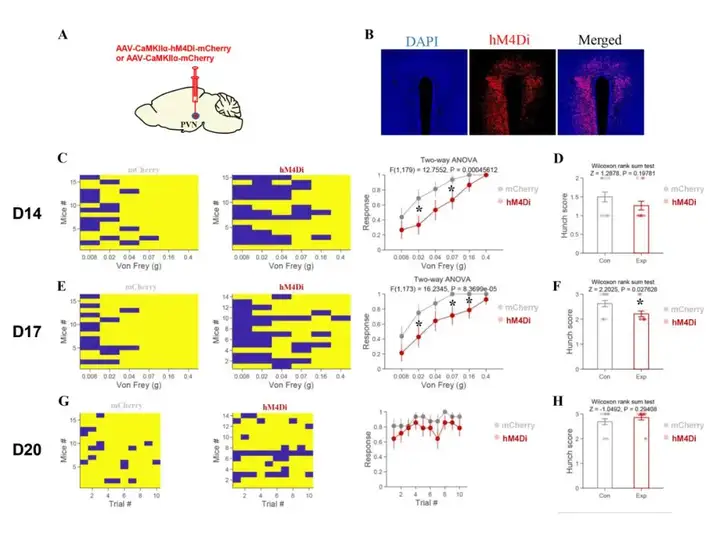
图7 化学遗传学抑制PVN谷氨酸能神经元可缓解胰腺癌诱发的内脏痛
作者为鉴定投射到PVN谷氨酸能神经元的上游脑区,探索它们参与内脏痛的调节机制,采用了Cre依赖的逆行跨单突触病毒示踪策略(图8A)。结果显示,在LSI(外侧隔核中间部)、视前内侧核(MPON)、终纹床核(BST)、下丘脑室旁核前部(PVA)、丘脑网状核(Rt)、下丘脑室旁核(PVN)、下丘脑背中侧部的背侧(DMD)中均发现dsRed标记的神经元,这些神经元对PVN脑区的谷氨酸能神经元具有投射(图8B,8C)。
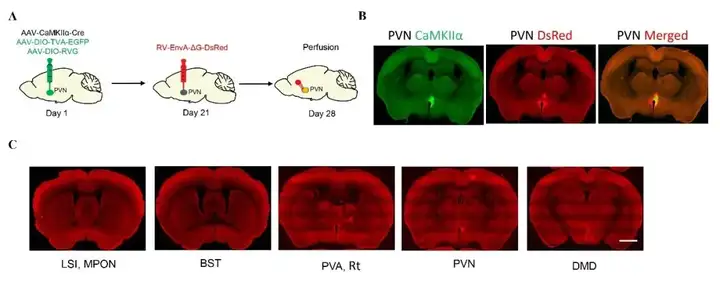
综上,本研究通过系列试验证明PVN脑区的谷氨酸能神经元参与了胰腺癌诱发的内脏痛的调节,对其特异性的抑制可以缓解胰腺癌诱发的内脏痛,这项发现为寻找治疗胰腺癌诱发的内脏痛的有效靶点提供了新的思路。同时调控内脏痛的中枢机制复杂,且PVN脑区具有高度异质性,不排除其他类型的神经元也参与其中。因此在未来研究中,应充分分析PVN脑区在内脏痛中的作用,尝试在不同类型的内脏痛动物模型中研究更多类型的神经元对内脏痛的调控机制,关注在内脏痛发生中PVN脑区不同类型神经元的相互作用。
夏明教授课题组长期从事癌痛和神经病理性疼痛的基础和临床研究。上海交通大学医学院附属第九人民医院博士后姬宁宁为论文的第一作者,上海交通大学医学院附属第九人民医院夏明教授、姜虹教授和中日友好医院樊碧发教授为论文的通讯作者。该工作得到了国家自然科学基金、上海市科技重大专项、上海领军人才、上海市科委医学创新研究专项以及上海交通大学医学院附属第九人民医院博士后科研启动基金的大力支持。
通讯作者

第一作者

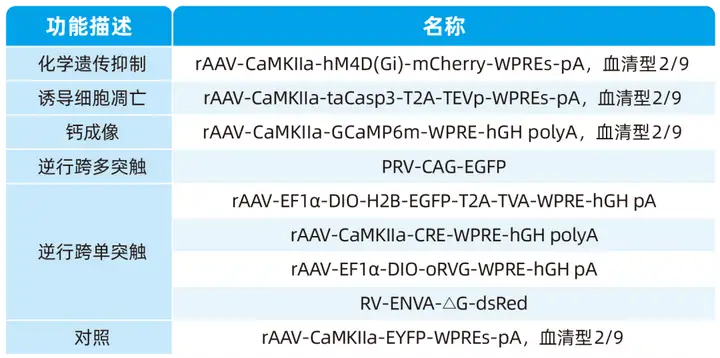
本文使用的病毒产品均来自枢密科技,列表如下:
* 电生理相关实验枢密参与合作完成
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
如有相关需求,或了解更多产品服务,欢迎咨询我们!
点击进入店铺,查看更多产品及服务