武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【客户文章】《Nat. Commun.》首次发现circAnks1a参与调控神经病理性疼痛的发生
281 人阅读发布时间:2023-06-14 10:41
许多信号级联和分子参与神经病理性痛疼的发生发展,例如神经炎症应答、嘌呤受体、内源性阿一片肽和神经营养因子,然而,神经病理性疼痛的分子机制尚不清楚。
circRNAs是内源性非编码RNA,形成共价闭合环;它们的序列在物种之间是保守的,并且它们比线性mRNAs具有更高的稳定性。大多数circRNAs在哺乳动物大脑中高表达,这表明它们可能在病理过程中发挥重要作用。circRNAs已被证明是竞争的内源性RNA,通过互补碱基配对结合miRNAs,并调节目标mRNAs的翻译。最近的研究表明,神经损伤改变了大鼠脊髓背角中circRNA的表达,但circRNA是否以及如何参与神经病理性疼痛尚未见报道。
近日,中山大学中山医学院信文君教授团队与中山大学孙逸仙纪念医院马超教授团队合作在《Nature Communications》发表题为“CircAnks1a in the spinal cord regulates hypersensitivity in a rodent model of neuropathic pain”的研究成果。该成果首次揭示了脊髓特异性circAnks1a介导神经病理性疼痛的发生,阐明了神经病理性疼痛的新机制,为治疗神经病理性疼痛提供了特异性靶点。

1. 脊髓背角circRNAs的测序
为了确定神经病理性疼痛发病机制中的关键circRNA,课题组收集了脊神经结扎(spinal nerve ligation, SNL)和假手术后大鼠的脊髓背角组织,并使用RNA-seq检测circRNAs的表达。结果发现,circ: chr20:7561057-7573740 (circAnks1a)在SNL处理后第3、7、10、14天表现出显著的增加。
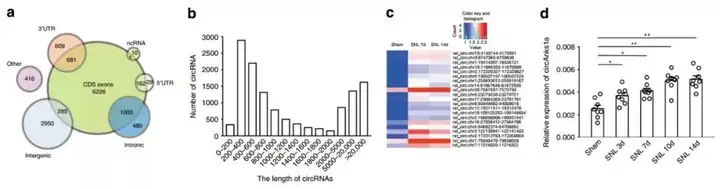
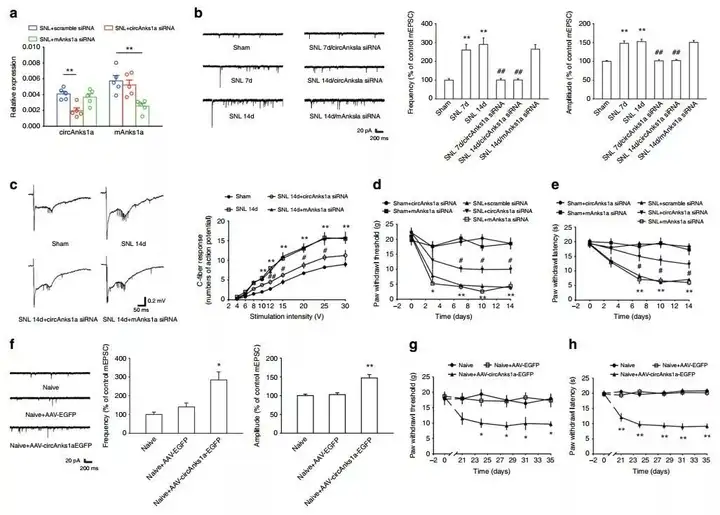
2. 确定circAnks1a在神经病理性疼痛中的作用
为了证实circAnks1a与神经病理性疼痛有关,课题组检测了接受治疗的动物的电生理变化和疼痛行为的变化。实验中设计了两个小干扰RNA (siRNA),其中一个靶向circAnks1a,目的是抑制circAnks1a的表达,另一个靶向mAnks1a,目的是敲低mAnks1a。电生理学实验表明,在神经损伤的7 天及14天后脊髓切片中,兴奋性突触后微电流(miniature excitatory postsynaptic currents, mEPSCs)、动作电位及兴奋性突触后电位-动作电位偶联(excitatory postsynaptic potentials-spike coupling)的频率和幅度在NK1R阳性神经元(免疫反应活性与circAnks1a阳性细胞共定位)中都显著增强,此外,体内实验表明,SNL后C纤维诱发的动作电位增多。注射circAnks1a干扰病毒后,减弱了以上神经元的活动,热痛觉足底实验退缩的阈值和潜伏期都增加了,而注射mAnks1a干扰病毒后,对mAnks1a的抑制并没有减弱这些神经元的活动,也没有增加热痛觉足底实验退缩的阈值和潜伏期。
随后,在L4–L6脊髓椎管内注射AAV-hSyn-circAnks1a-nEF1α-EGFP病毒过表达circAnks1a,病毒注射后21天,在背角出现明显的绿色荧光,且circAnks1a水平升高。经电生理和行为学检测,神经元活动增强,足底实验退缩的阈值和潜伏期减少。以上结果表明,circAnks1a介导神经病理性疼痛的发生。
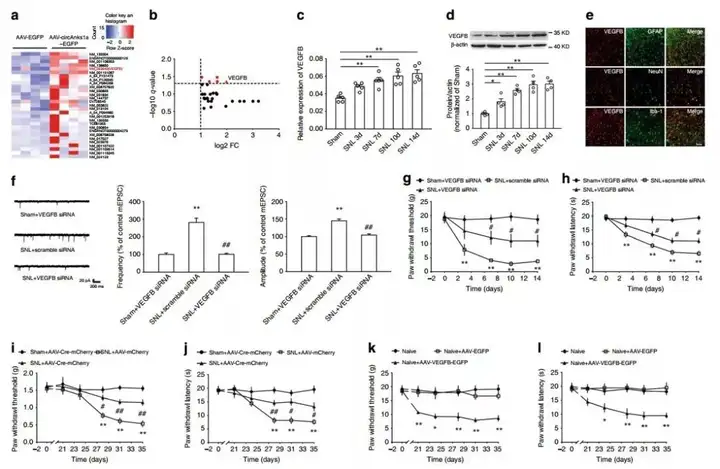
3. VEGFB促进神经元兴奋和神经病理性疼痛
为了阐明circAnks1a调控神经病理性疼痛的分子机制,使用全基因组表达芯片检测circAnks1a过表达前后的转录本变化,发现血管内皮生长因子(VEGFB)mRNA表达量显著增加,此外,在SNL模型中,VEGFB的mRNA及蛋白在SNL后第3,7,10和14天也显著高于假手术组。为了确定VEGFB是否促进神经病理性痛疼,通过鞘内注射干扰VEGFB病毒和椎管内注射过表达VEGFB的病毒载体,并检测了由此引起的电生理特征和疼痛行为的改变,结果表明VEGFB在神经损伤引起的神经病理性疼痛的发生过程中起着重要的作用。
4. 在神经病理性疼痛中,circanks1a增强VEGFB的表达
探究团队进一步研究了在SNL诱导的神经病理性疼痛中,VEGFB的上调是否由circAnks1a介导。结果显示,circAnks1a与VEGFB共定位,在SNL 14天后鞘内注射circAnks1a干扰病毒,可以减少VEGFB mRNA及其蛋白的表达;而椎管内注射circAnks1a过表达病毒可以显著增加VEGFB mRNA及其蛋白的水平。这些结果表明SNL后脊髓背角VEGFB的上调依赖于circAnks1a的表达。
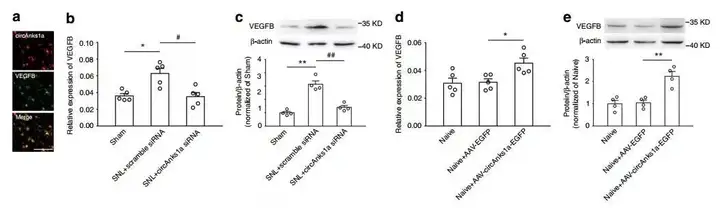
5. circAnks1a促进了YBX1的核易位
接下来为了阐明circAnks1a调节SNL后脊髓背角VEGFB表达的分子机制,团队使用RNA pulldown、质谱分析、western blot、Co-IP、EMSA等实验来寻找潜在与circAnks1a相互作用的蛋白,结果显示,YBX1与circAnks1a密切相关。
转录因子YBX1通常在转移到细胞核后执行其功能,因此,团队检测了SNL后脊髓背角组织细胞核YBX1的水平。结果表明,在SNL后第7天和第14天,细胞核YBX1显著增加,而总的YBX1没有明显增加。众所周知,转运蛋白-1在胞质-核转运中起着重要作用,接着进一步通过Co-IP、EMSA证实circAnks1a通过直接与YBX1作用,增强YBX1和转运蛋白-1之间的相互作用,从而促进神经损伤后YBX1在背角的核易位。
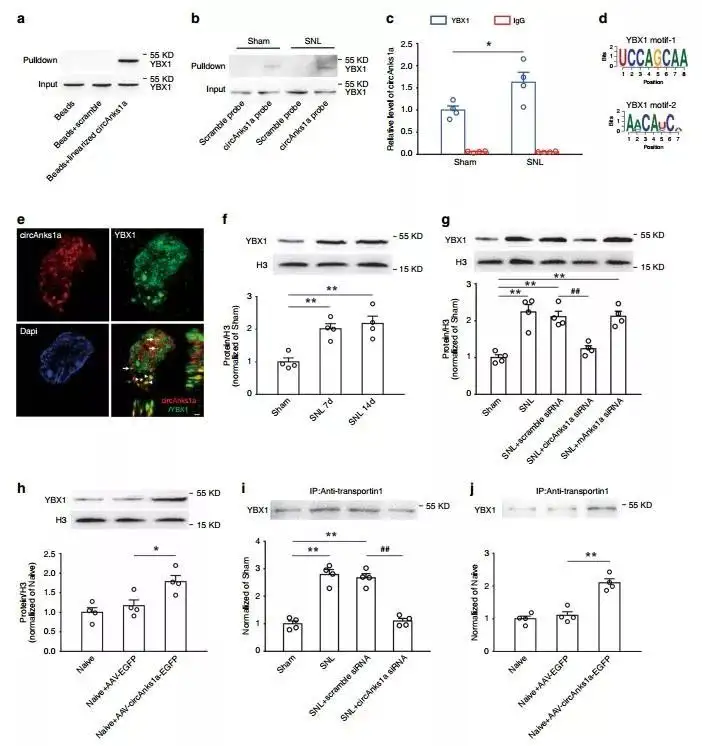
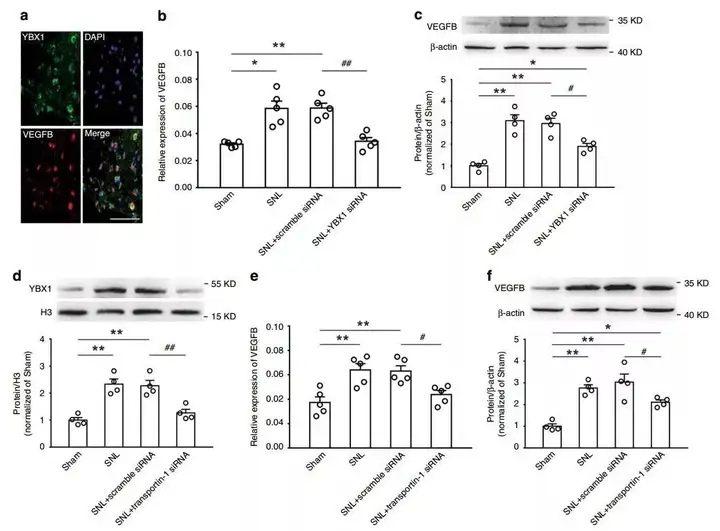
6. YBX1促进VEGFB的表达
为了弄清核内增加的YBX1是否参与了SNL后观察到的Anks1a介导的VEGFB上调,鞘内注射YBX1干扰病毒,结果显示完全阻碍了SNL大鼠VEGFB mRNA的上调,并部分减弱了SNL大鼠VEGFB蛋白的增加。
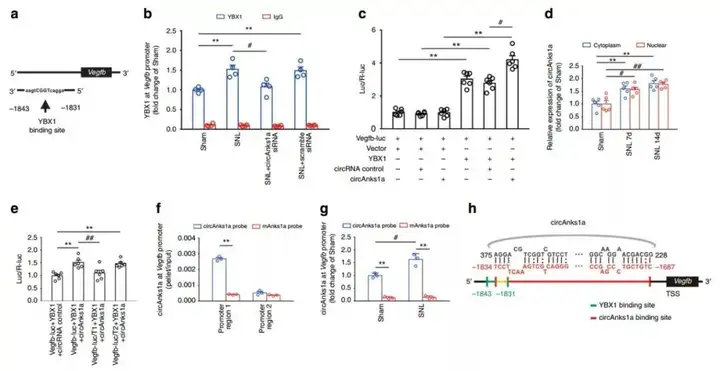
7. circAnks1a促进YBX1向Vegfb启动子区的募集
YBX1在Vegfb启动子区有特异性结合位点,ChIP实验表明,在SNL后第14天,YBX1向Vegfb启动子的募集显著增加。为了进一步证实YBX1与Vegfb启动子区的结合是功能性的,将Vegfb启动子的2200bp片段与pGL3-Basic载体的荧光素酶基因融合,生成Vegfb-Luc报告基因。通过检测转染293T细胞中的荧光素酶活性来评估启动子活性。过表达YBX1与circAnks1a后,Vegfb的转录显著增加,而仅过表达circAnks1a,对Vegfb的转录没有影响。进一步实验证明细胞核中的circAnks1a直接与Vegfb基因结合,并通过向Vegfb启动子区募集YBX1来促进Vegfb的转录。
8. circAnks1a可以结合miR-324-3p
先前的实验结果显示,鞘内注射YBX1干扰病毒,完全阻碍了SNL大鼠VEGFB mRNA的上调,并部分减弱了SNL大鼠VEGFB蛋白的增加。考虑到注射circAnks1a干扰病毒后,完全抑制了SNL诱导的VEGFB蛋白的上调,说明可能存在另一条非YBX1依赖的途径,circAnks1a通过该途径在神经损伤的环境中调节VEGFB的表达。
众所周知,miRNAs在转录后调节中起着关键作用,而细胞质circRNAs可以结合miRNA来调节靶基因的翻译。团队通过荧光素报告基因、RNA pull-down及FISH实验证实circAnks1a可以吸附miR-324-3p。
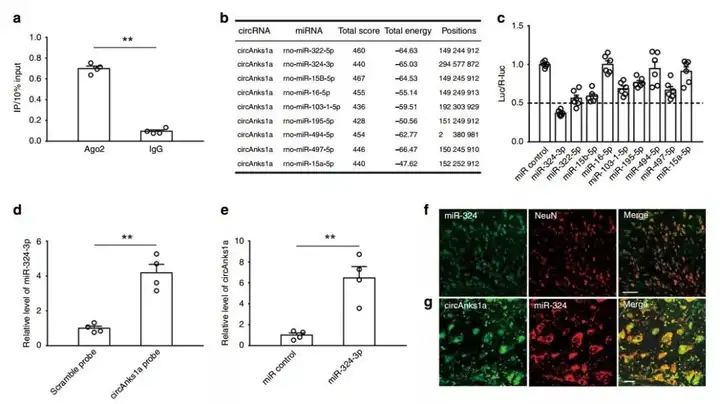
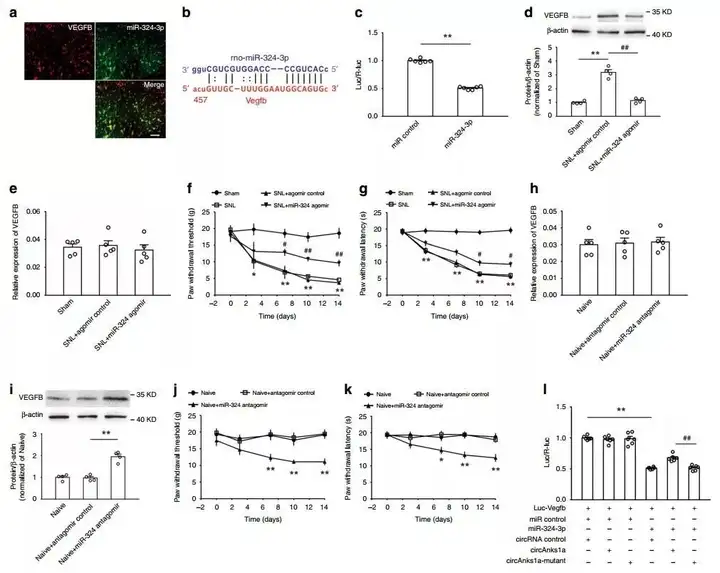
9. circAnks1a通过结合miR-324-3p解除了对VEGFB翻译的抑制
实验在体鞘内注射miR-324-3p激动剂“agomir”,结果显示可以显著减弱SNL第14天后VEGFB蛋白表达的增加,但不改变VEGFB mRNA的水平;鞘内注射miR-324-3p拮抗剂“antagomir”,结果显示没有改变VEGFB mRNA的水平,但明显地促进了VEGFB蛋白的表达。这些结果表明,miR-324-3p可以抑制VEGFB的翻译,SNL后circAnks1a通过结合miR-324-3p解除了对VEGFB翻译的抑制。
总结
在这项研究中,团队使用了枢密的AAV过表达病毒载体,首次证明了:1)脊髓特异性circAnks1a介导神经病理性疼痛的发生,VEGFB促进神经元兴奋和神经病理性疼痛;2)circAnks1a促进转录因子YBX1易位进入细胞核,此外,细胞核circAnks1a在神经损伤后直接与Vegfb基因结合,并通过向Vegfb启动子区募集YBX1来促进Vegfb的转录,增强VEGFB的表达;3)在神经损伤后circAnks1a调控VEGFB的表达还存在一条非YBX1依赖的途径,即细胞质circAnks1a可通过碱基互补配对结合miR-324-3p,并增强VEGFB mRNA的翻译。
原文链接:https://www.nature.com/articles/s41467-019-12049-0
如有相关实验需求,或了解更多产品服务,欢迎咨询我们!