武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
IF=9.587【客户文章】南京医科大学马腾飞/周丽教授团队合作发现NLRP3通过皮质纹状体环路调控酗酒戒断诱发的焦虑行为
985 人阅读发布时间:2023-06-14 10:31
酒精使用障碍(Alcohol use disorders,AUDs)是一种复杂的脑部疾病,由反复酗酒与长期饮酒所引起[1,2]。长期过度饮酒也会导致神经炎性反应与戒酒后焦虑行为[3,4]。尽管炎性反应与AUDs有关[5],但饮酒和戒酒诱发的焦虑行为导致神经炎症的直接证据仍不清楚。NOD样受体热蛋白结构域相关蛋白3(The NOD-like receptor family pyrin domain containing-3,NLRP3)免疫激酶体协调先天免疫反应的关键分子复合物[6]。研究表明,NLRP3炎性小体在酒精诱导的神经免疫反应的调节中起着至关重要的作用[7]。然而,抑制NLRP3炎性小体是否以及如何改变酒精摄入和戒酒诱发的焦虑行为尚不清楚。
2022年12月,南京医科大学马腾飞/周丽教授课题组在Journal of Neuroinflammation上发表了题为“NLRP3 defciency decreases alcohol intake controlling anxiety-like behavior via modifcation of glutamatergic transmission in corticostriatal circuits”的研究论文,硕士研究生李子艺、博士研究生Olivia Ewi Vidjro和本科生郭庚妮为论文共同第一作者,马腾飞教授和周丽博士为论文共同通讯作者。研究发现NLRP3通过调控大脑皮质纹状体环路中的谷氨酸能传递来影响酒精摄入和戒酒诱导的焦虑样行为。

1. NLRP3下调可缓解酗酒戒断诱发的焦虑样行为
作者使用C57BL/6野生型小鼠和NLRP3 KO基因敲除小鼠构建酗酒模型(图1 A-C)。通过旷场试验(open-field test,OFT)和高架十字迷宫(elevated plus maze,EPM)检测小鼠焦虑样行为。在OFT测试中,NLRP3基因敲除组(NLR. KO+Alco.)小鼠在旷场中心区的活动时间显著增加(图1 D-E)。在EPM测试中,NLRP3基因敲除组(NLR. KO+Alco.)小鼠在开放臂的活动时间及进入开放臂次数显著增加(图1 F-G)。此外,三组小鼠在OFT和EPM中运动能力均无明显差异。这些结果(图1)表明NLRP3下调可缓解酗酒戒断诱发的焦虑样行为。
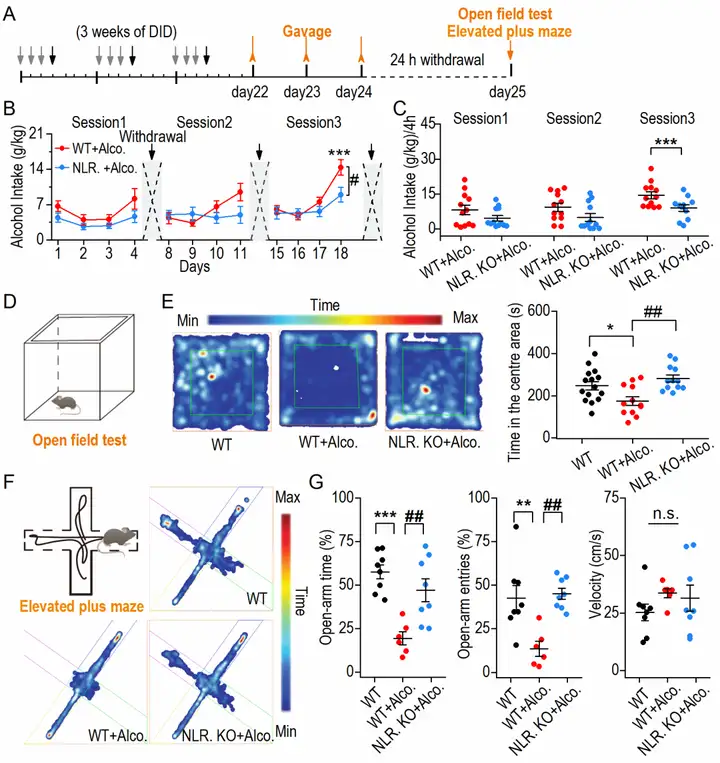
图1 NLRP3下调可缓解酗酒诱发的焦虑样行为(图源:Li Z, et al., J Neuroinflammation, 2022)
2. NLRP3在诱导炎性级联信号转导和神经元损伤中起重要作用
作者在证明NLRP3下调可减少酗酒诱导的焦虑样行为后,进一步探究其背后的特定炎性反应机制。大脑内侧前额皮质(medial prefrontal cortex,mPFC)调节焦虑行为[8],纹状体(Striatum)与奖赏密切相关[9]。首先,作者采用尼氏染色,发现NLRP3下调缓解酗酒引发的mPFC和Striatum脑区尼氏小体的损伤(图2 A)。再通过蛋白免疫印迹(WB)实验,发现NLRP3下调可进一步抑制其下游蛋白Caspase-1的表达(图2 B-C)。最后,酶联免疫吸附(ELISA)试验表明NLRP3下调可抑制IL1-β和TNFα炎性因子的表达(图2 D-E)。这些结果(图2)表明NLRP3下调可降低炎性级联信号转导和神经元损伤。
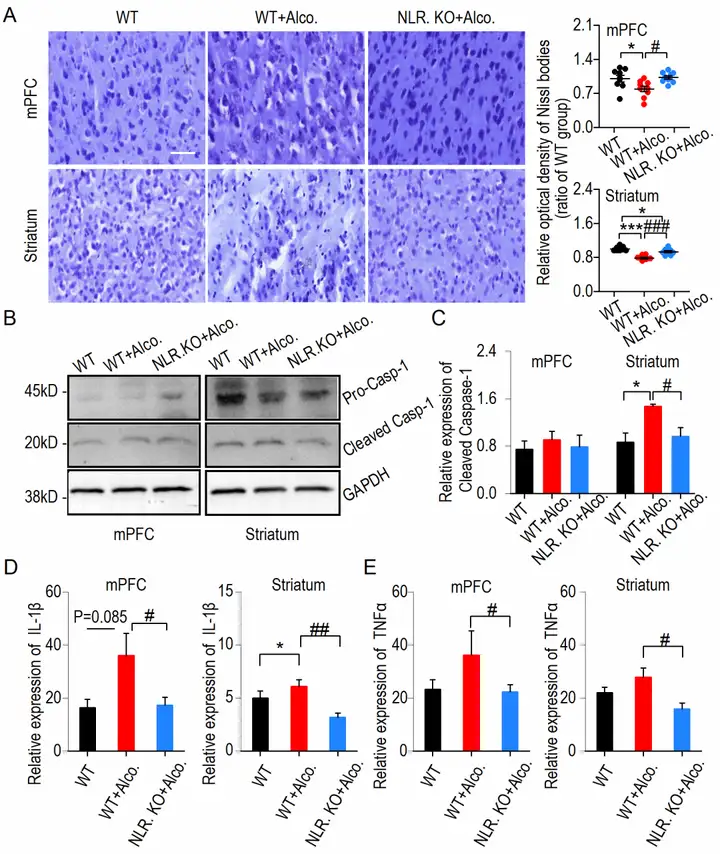
图2 酗酒诱发焦虑样行为后mPFC和Striatum脑区NLRP3级联信号转导及神经元损伤(图源:Li Z, et al., J Neuroinflammation, 2022)
3. NLPR3下调减少焦虑样行为并调控谷氨酸能皮质纹状体环路
作者采用光遗传技术(optogenetics)检测条件性激活皮质纹状体环路对酗酒戒断诱发的焦虑样行为的影响(图3 A-C)。与未给予光诱导的NLRP3 KO(NLR. KO+Alco.)组相比,光激活皮质纹状体环路(NLR. KO+Alco.+LTP)组小鼠在旷场中心区活动时间降低,提示光激活该环路翻转了NLRP3下调的抗焦虑作用(图3 D)。离体电生理对行为学结果进行了进一步验证(图3 E-G)。这些结果(图3)表明NLPR3下调减少焦虑样行为并调控谷氨酸能皮质纹状体环路。
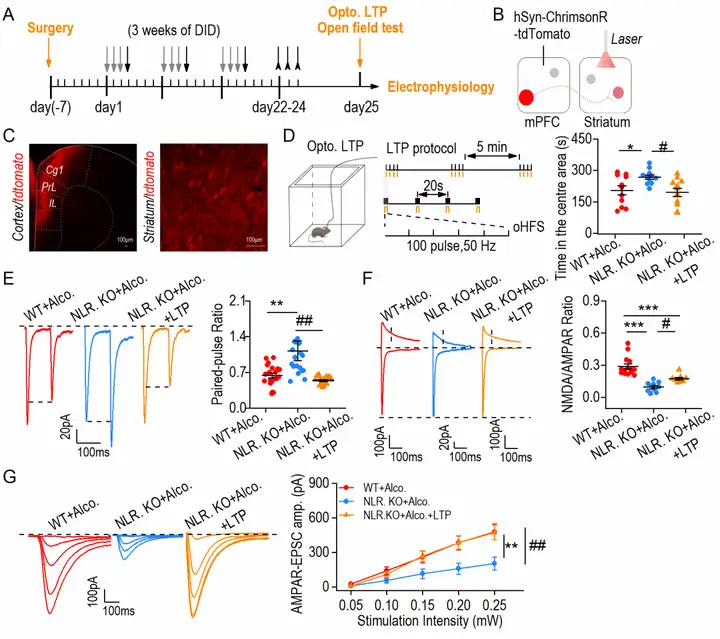
图3 NLPR3下调减少焦虑样行为并调控谷氨酸能皮质纹状体环路(图源:Li Z, et al., J Neuroinflammation, 2022)
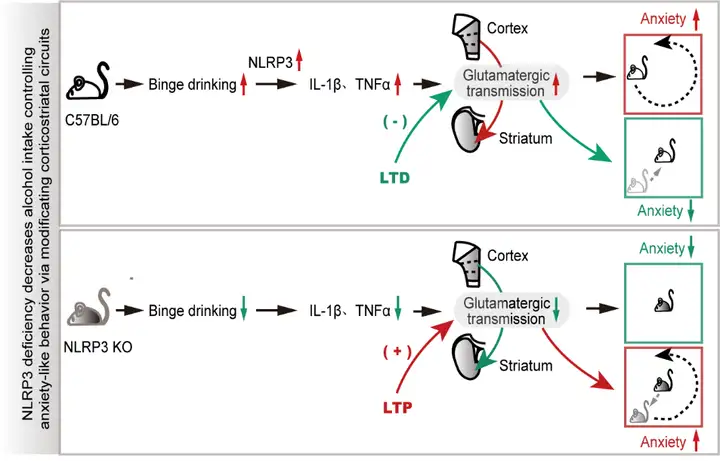
图4 工作总结图:酗酒可导致C57BL/6小鼠NLRP3炎性小体过度激活,进而增加焦虑样行为。光遗传诱导皮质纹状体谷氨酸能突触传递LTD,可缓解酒精戒断焦虑样行为。NLRP3 KO小鼠酗酒摄入量明显降低,且下游的炎性因子表达减少,从而焦虑样行为得到缓解。光遗传诱导该环路LTP可逆转NLPR3下调缓解焦虑样行为的
文章结论与讨论,启发与展望
综上所述,本研究发现NLRP3下调可缓解酗酒戒断诱发的焦虑样行为,且该机制在神经元和分子蛋白水平都得到验证。条件性激活皮质纹状体环路可逆转NLRP3下调缓解的戒酒焦虑样行为,而条件性抑制该环路可起到缓解酗酒戒断诱发焦虑的作用,因此提示NLRP3信号通路是治疗酒精使用障碍的重要调节因子,大脑皮质纹状体环路也是缓解酗酒行为的潜在靶点。本文使用雄性小鼠进行行为学及机制的探究,未来仍需开展NLRP3介导雌性小鼠在酗酒及戒酒焦虑行为中的作用机制的研究。
南京医科大学药学院硕士研究生李子艺、博士研究生Olivia Ewi Vidjro和本科生郭庚妮为论文共同第一作者,南京医科大学马腾飞教授和南京妇幼保健医院周丽博士为论文共同通讯作者。本研究由国家自然科学基金、江苏省神经退行性疾病重点实验室开放基金、江苏省高等学校大学生创新创业训练计划项目和江苏省自然科学青年基金资助。
参考文献
[1] Carvalho AF , Heilig M, Perez A, Probst C, Rehm J. Alcohol use disorders. Lancet. 2019;394:781–92.
[2] Wiers CE, Vendruscolo LF , van der Veen JW, Manza P , Shokri-Kojori E, Kroll DS, Feldman DE, McPherson KL, Biesecker CL, Zhang R, et al. Ketogenic diet reduces alcohol withdrawal symptoms in humans and alcohol intake in rodents. Sci Adv. 2021;7:eabf6780.
[3] Peng H, Geil Nickell CR, Chen KY, McClain JA, Nixon K. Increased expression of M1 and M2 phenotypic markers in isolated microglia after four day binge alcohol exposure in male rats. Alcohol. 2017;62:29–40.
[4] Smith JP , Randall CL. Anxiety and alcohol use disorders: comorbidity and treatment considerations. Alcohol Res. 2012;34:414–31.
[5] McKim DB, Weber MD, Niraula A, Sawicki CM, Liu X, Jarrett BL, Ramirez Chan K, Wang Y, Roeth RM, Sucaldito AD, et al. Microglial recruitment of IL-1beta-producing monocytes to brain endothelium causes stress-
induced anxiety. Mol Psychiatry. 2018;23:1421–31.
[6] Andreeva L, David L, Rawson S, Shen C, Pasricha T, Pelegrin P , Wu H. NLRP3 cages revealed by full-length mouse NLRP3 structure control pathway activation. Cell. 2021;184:6299-6312.e6222.
[7] Roberto M, Patel RR, Bajo M. Ethanol and cytokines in the central nervous system. Handb Exp Pharmacol. 2018;248:397–431.
[8] Felix-Ortiz AC, Burgos-Robles A, Bhagat ND, Leppla CA, Tye KM. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 2016;321:197–209.
[9] Sequeira SL, Silk JS, Ladouceur CD, Hanson JL, Ryan ND, Morgan JK, McMakin DL, Kendall PC, Dahl RE, Forbes EE. Association of neural reward circuitry function with response to psychotherapy in youths with anxiety disorders. Am J Psychiatry. 2021;178:343–51.
本文使用的病毒产品均来自枢密科技,列表如下:
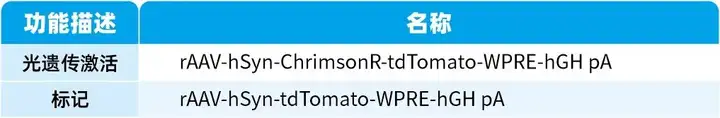
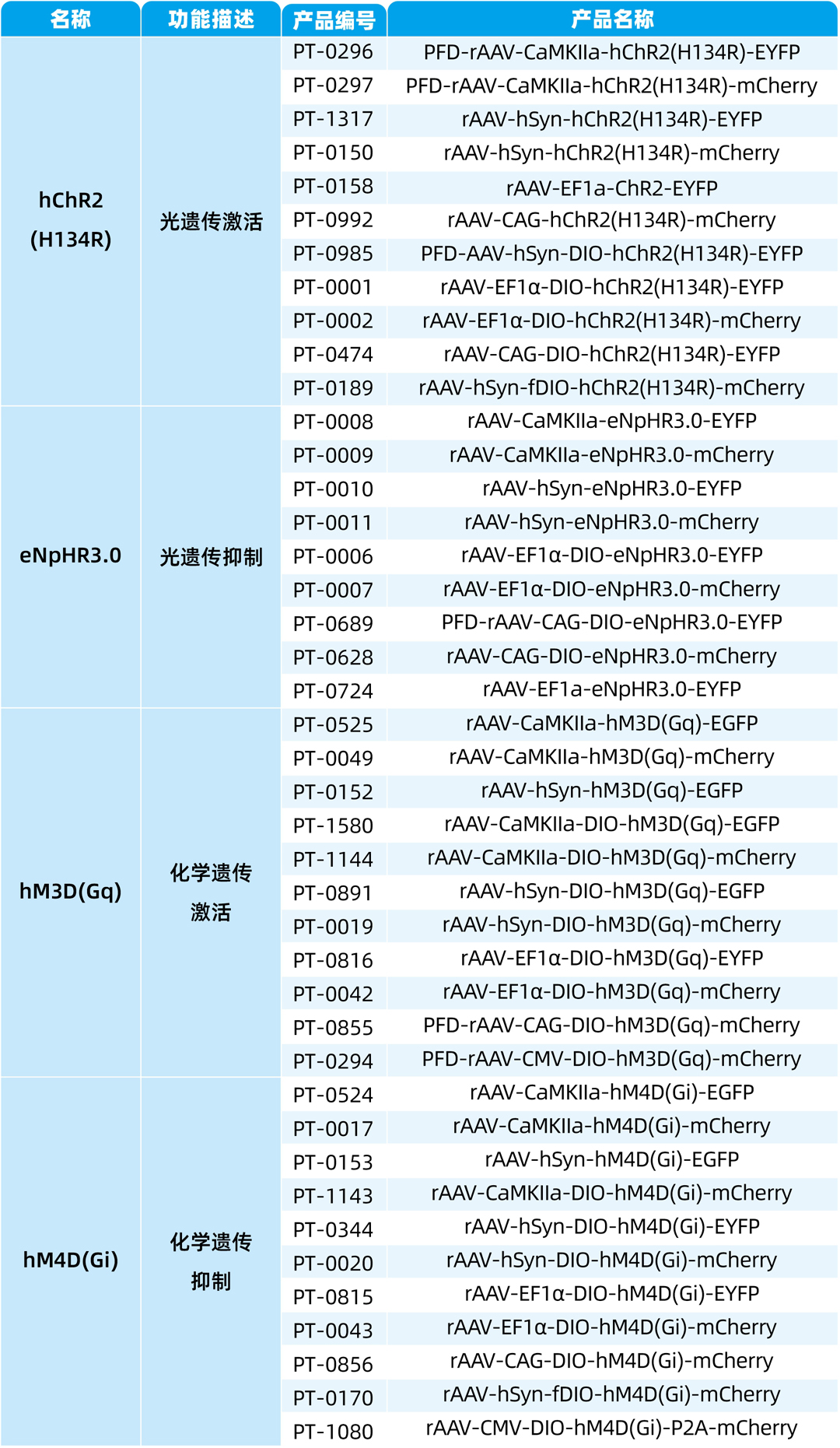
我司可提供光遗传、化学遗传病毒产品,病毒注射及动物实验服务等。部分相关病毒产品列表如下:
如有相关实验需求,或了解其他产品服务,欢迎扫码咨询!