武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【客户文章】Journal of Neuroscience | 空军军医大学李云庆教授、董玉琳副教授团队在pPVT-CeA-vlPAG下行通路参与疼痛易化研究中取得新进展
2074 人阅读发布时间:2023-06-13 10:02
慢性痛是一类严重威胁人类健康的慢性疾病,但其机制尚不清楚。丘脑是脑内最重要的感觉信息传导接替站,是感知、整合及传递各种感觉信息尤其是痛觉信息的重要部位。丘脑室旁核(paraventricular nucleus of the thalamus, PVT)属于丘脑中线核群,其功能越来越受到人们的关注。目前研究报道PVT主要参与昼夜节律、警惕和觉醒、应激如恐惧、某些相关情绪改变如焦虑和抑郁、动机与成瘾行为等过程。除参与上述情绪相关活动外,近年研究发现PVT也参与了疼痛调控。在急性胰腺炎小鼠脑内利用DREADDs(designer receptors exclusively activated by designer drugs)技术损毁PVT后,能够显著降低急性胰腺炎所致内脏痛动物的行为表现 ;在酸所致慢性痛模型中,可以激活PVT内的细胞外信号调节激酶(extracellular signal-regulated kinase,ERK),而抑制其内ERK的活性后能够消除动物的慢性机械性痛敏,研究结果表明ERK的激活是PVT参与慢性机械性痛敏的前提。尽管有以上关于PVT参与疼痛调控的报道,但其相关调控通路及具体细胞分子机制尚不清楚。
2020年10月7日,第四军医大学梁銶琚脑研究中心实验室李云庆教授、董玉琳副教授团队在神经科学权威期刊《Journal of Neuroscience》上在线发表题为“A Neural Circuit from Thalamic Paraventricular Nucleus to Central Amygdala for the Facilitation of Neuropathic Pain”的研究论文。该研究揭示了一条丘脑室旁核后部(pPVT)-杏仁中央核(CeA)-中脑导水管腹外侧区(vlPAG)之间的神经通路,此通路在神经病理性痛信息调控下发挥易化作用,为慢性痛中枢下行调控机制研究提供新思路。

1.损毁或抑制pPVT神经元活性可以增加SNI大鼠的机械性痛阈值
利用海人藻酸(kainic acid,KA)(图1)化学损毁pPVT或利用DREADDS技术(图2)特异性抑制pPVT神经元,均能使神经病理性痛大鼠的机械性痛阈值升高,发挥镇痛作用。
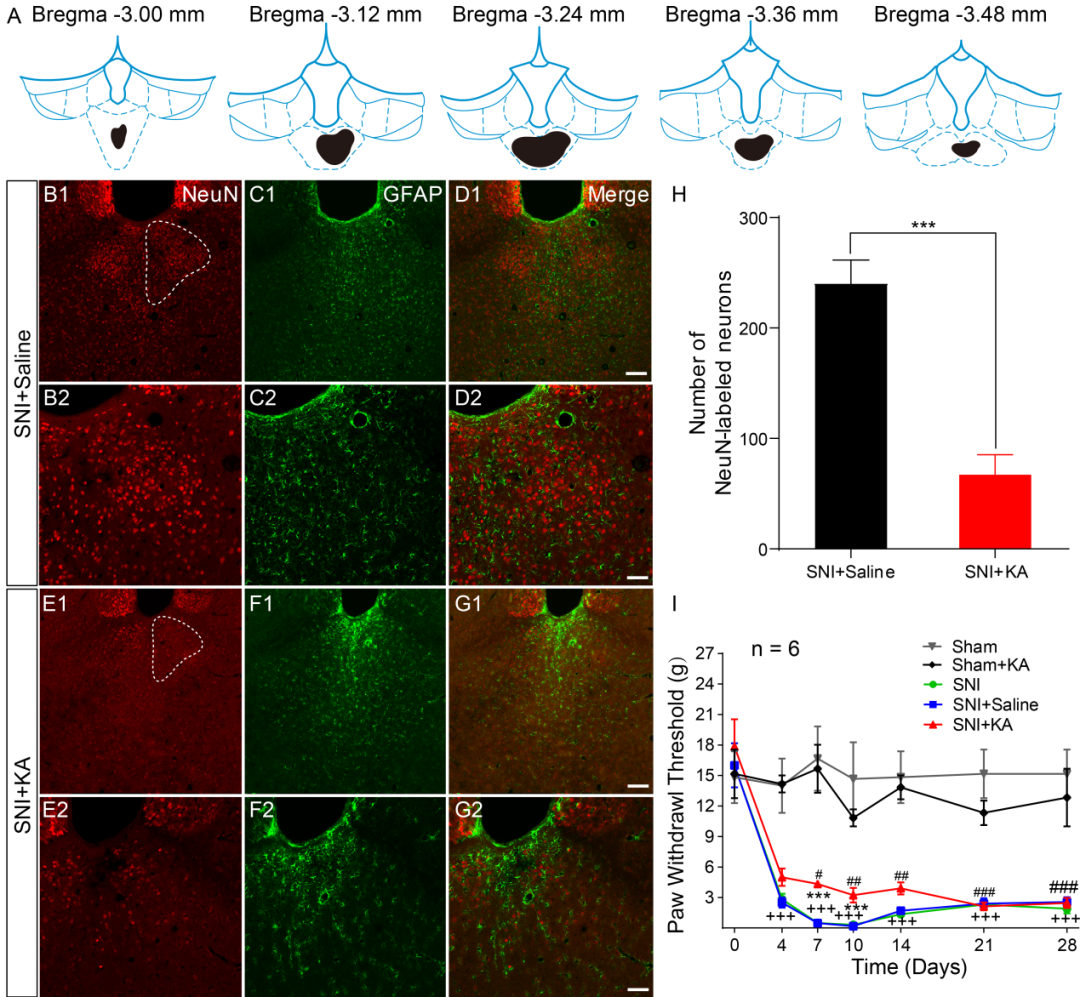
图1注射KA损毁pPVT对神经病理性痛的作用
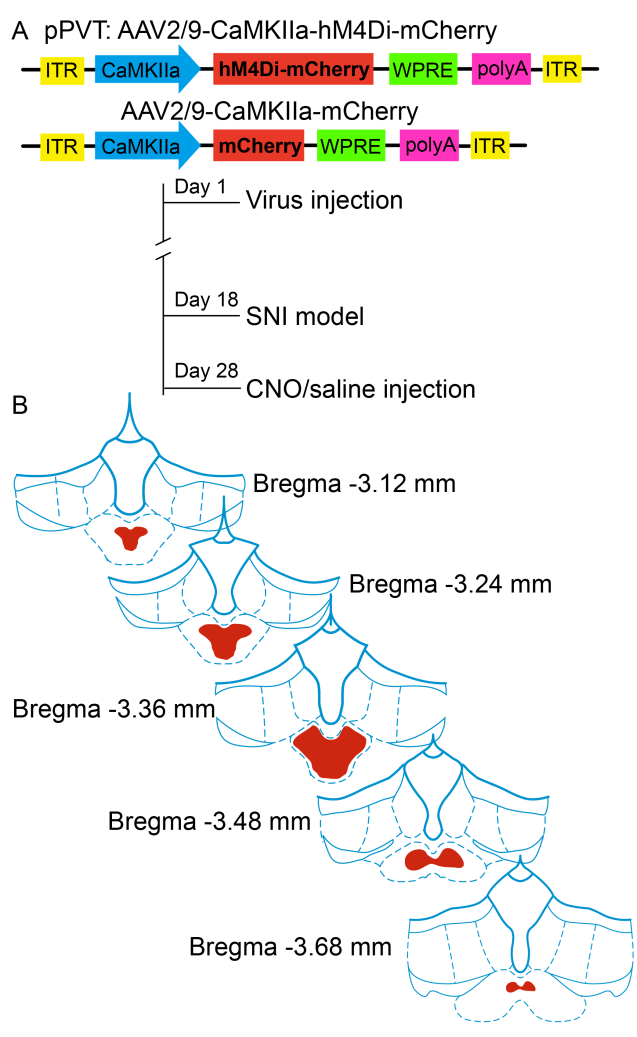
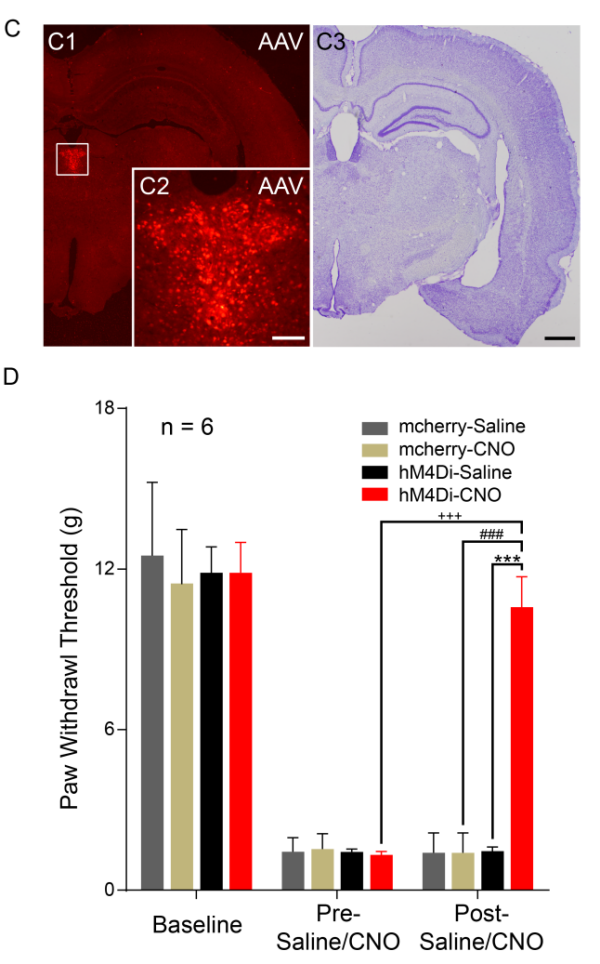
图2 DREADDS技术抑制pPVT神经元活性对神经病理性痛的影响
2、pPVT的痛觉易化作用是通过pPVT-CeA通路产生的
顺、逆行束路追踪结果显示pPVT与CeA之间存在纤维联系,且原位杂交结合逆行神经束路追踪技术观察到pPVT-CeA通路上pPVT投射神经元表达VGLUT2 mRNA,即pPVT神经元为VGLUT2阳性的谷氨酸能神经元。FOS染色提示神经病理性痛条件下pPVT内该通路上投射神经元可以被激活。
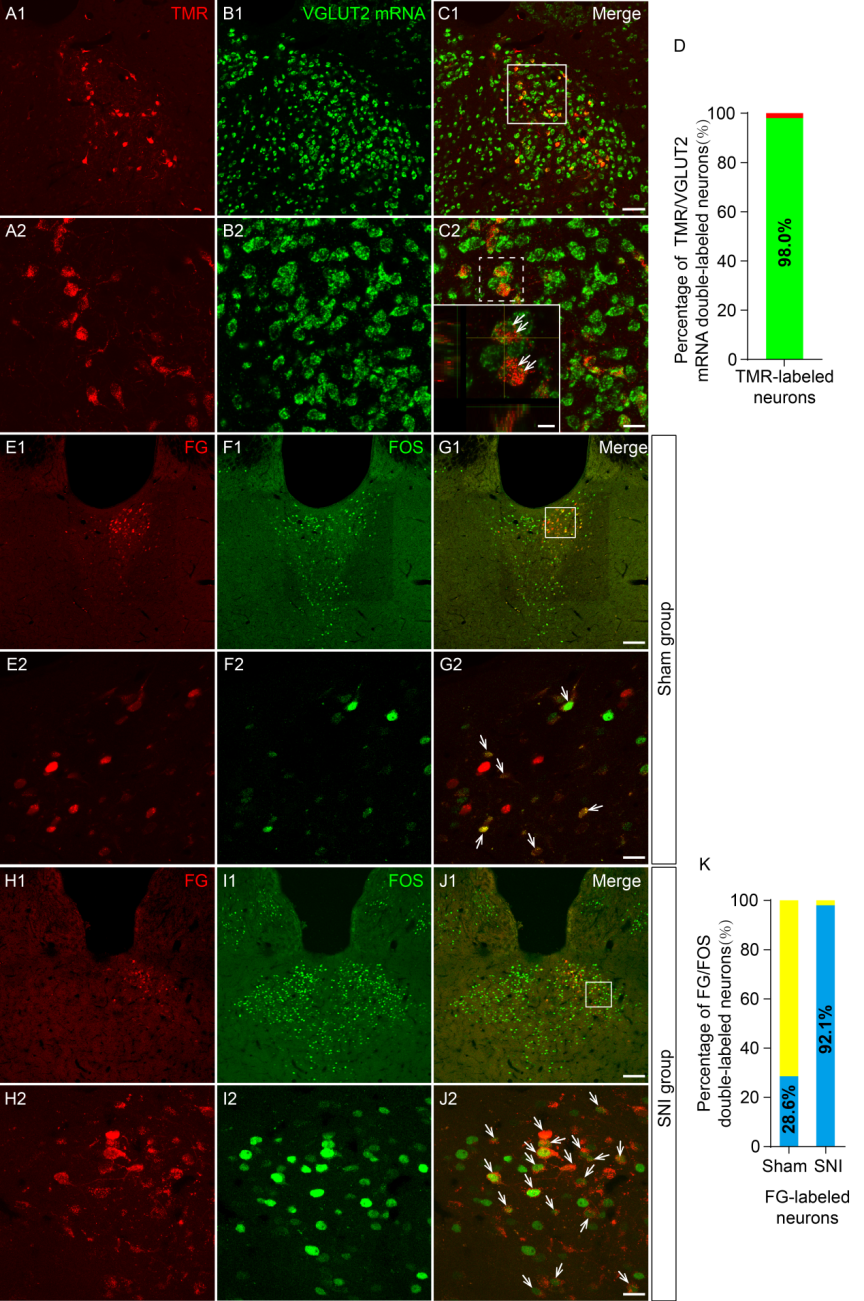
接下来作者进一步运用电生理技术观察神经病理性痛状态下pPVT-CeA通路的激活状态。与假手术组相比,SNI组的自发兴奋性突触后电流(sEPSCs)的幅度和频率均增加、rheobase电流显著降低、平均静息膜电位(RMP)增加,这些结果表明在神经病理性疼痛条件下pPVT-CeA投射神经元的兴奋性增强。
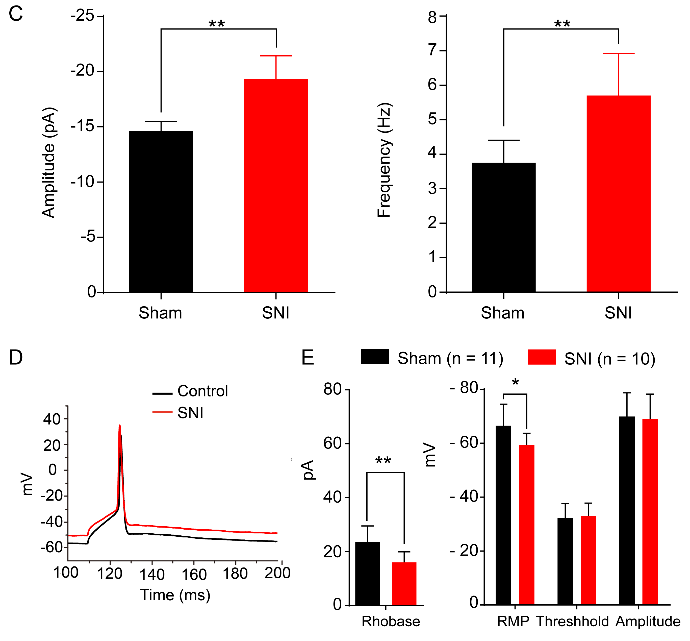
图4 神经病理性痛状态下pPVT-CeA投射神经元的电生理学记录
4、pPVT-CeA-vlPAG通路参与疼痛调节的形态学证据
将顺行示踪剂BDA注入pPVT,逆行示踪剂FG注入vlPAG,免疫荧光下在CeA内可观察到BDA阳性终末呈串珠样围绕在FG逆标胞体周围,两者之间存在密切接触。进一步在电镜观察到CeA内BAD阳性轴突终末与纳米金标记的FG阳性树突形成突触,大部分突触的突触后膜上可见增厚的突触后致密带,提示该突触为非对称性突触,即兴奋性突触。
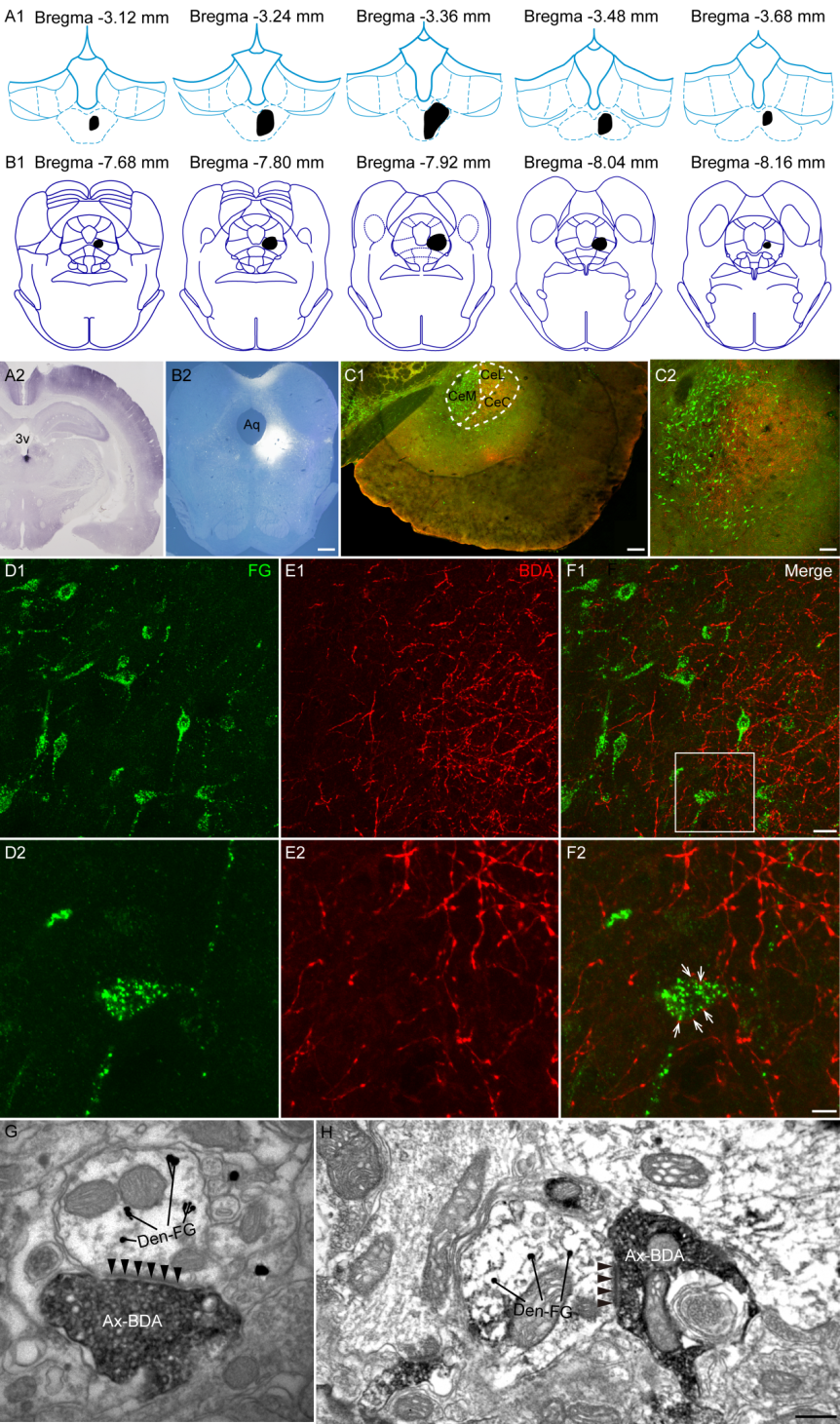
图5 pPVT-CeA-vlPAG神经通路的免疫荧光及免疫电镜双标染色
已有研究表明谷氨酸能神经元是vlPAG中重要的镇痛神经元。作者最后采用病毒顺行追踪结合狂犬病毒逆行跨突触标记技术显示了一条pPVTGLU-CeAGABA-vlPAGGLU的下行疼痛易化通路,即vlPAG中的谷氨酸能神经元是pPVT-CeA通路的下游靶点。
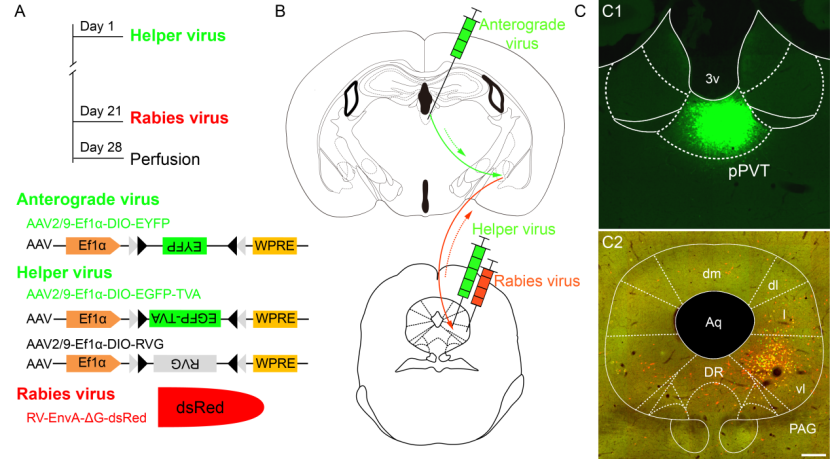
图6 pPVT-CeA-vlPAG通路的狂犬病毒跨突触标记荧光染色
总结团队使用了枢密科技的病毒工具,通过联合应用神经环路示踪、药物遗传学、电生理记录、狂犬病毒逆行跨突触标记等技术,证实在慢性痛状态下PVT内的VGLUT2阳性神经元被激活,使得向CeA内GABA能神经元投射的纤维终末内Glu释放增加,GABA的合成和释放增多,后者进一步抑制vlPAG内的VGLUT2阳性神经元,最终发挥易化疼痛的效应。
原文链接:https://pubmed.ncbi.nlm.nih.gov/32958568/
本文涉及产品
|
AAV2/9-CaMKIIa-hM4Di-mCherry |
|
AAV2/9-CaMKIIa-mCherry |
|
AAV2/9-Ef1a-DIO-EYFP |
|
AAV2/9-Ef1a-DIO- EGFP-TVA |
|
AAV2/9-Ef1a-DIO-RVG |
|
RV-EnvA-ΔG-dsRed |
产品相关:
如有相关需求,或了解更多产品服务,欢迎扫描下方二维码咨询我们!!!
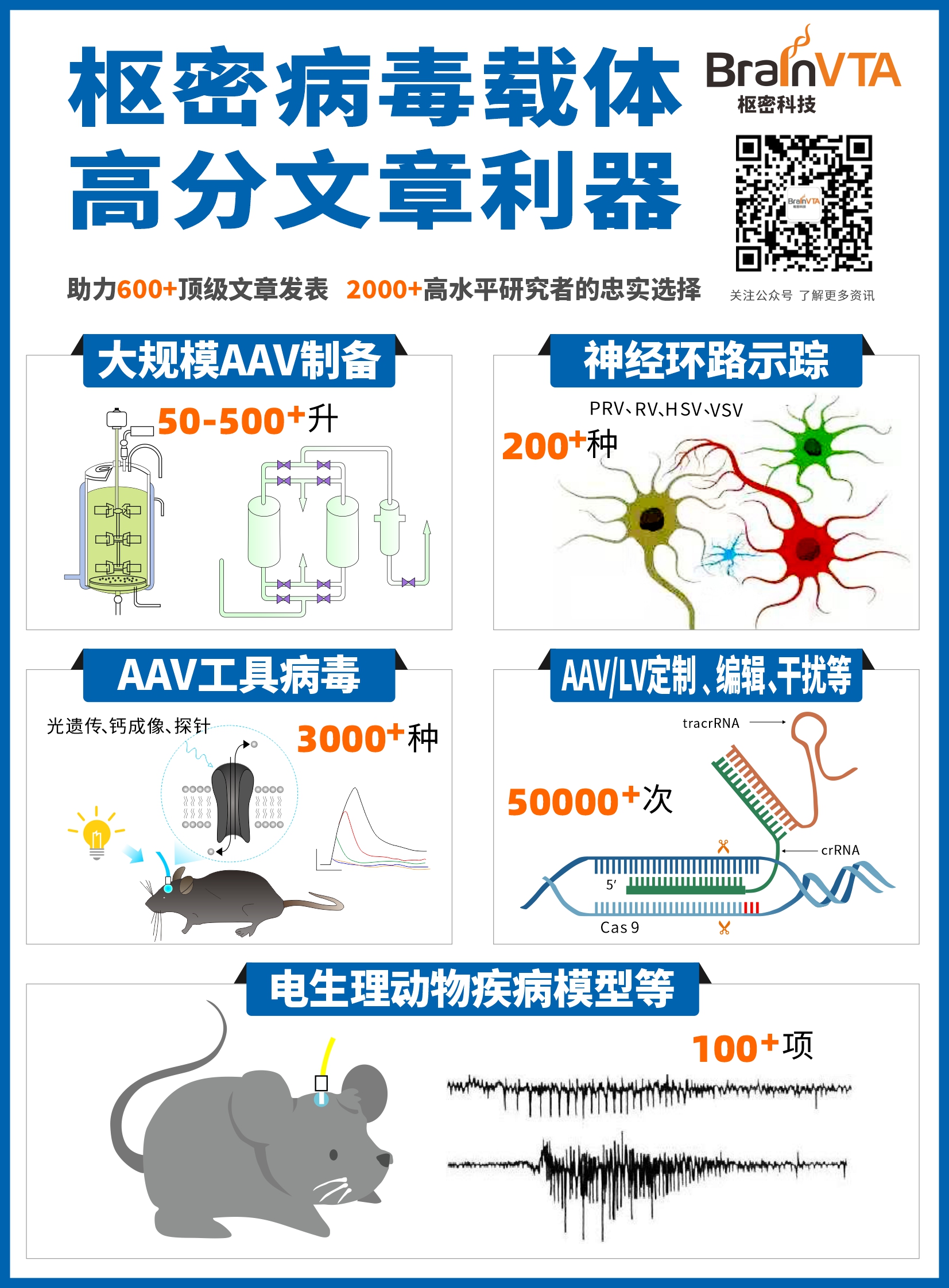
公司相关业务:基因编辑(敲入、敲除、点突变、敲低、过表达、干扰等)、行为学小鼠模型构建、干细胞诱导分化、神经示踪、整包服务等。







