武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
AAV 在眼科中应用研究
1767 人阅读发布时间:2023-10-19 13:55
二十世纪八十年代以来, 基因治疗已经应用到许多眼部疾病的研究中。腺相关病 (adeno-associatedvirus, AAV) 载体作为基因转移载体具有安全性好、宿主范围广、免疫原性低和携带的治疗基因长期表达等优势而成为眼病基因治疗研究的热点, 部分研究已进入临床试验 阶段。与其它器官相比,眼睛作为小器官有着独有的优势,例如所处的环境相对封闭,远离其他组织,减少交叉感染风险;眼部基因治疗的靶器官大部分是终未分化细胞,减少了诱发肿瘤的风险;AAV可以感染多种眼部细胞,包括光感受器、视网膜色素上皮细胞、米勒细胞、视网膜神经节细胞等。AAV对眼部细胞的转染较稳定,可转染分裂细胞和非分裂细胞,且在眼部的免疫反应较弱,具有较强的优势。
目前大约有2%与基因治疗相关的临床试验聚焦于眼科疾病,主要是各种类型的视网膜营养不良(如Leber先天性黑朦,无脉络膜症,Stargardt黄斑变性),先天性聋视网膜色素变性综合征1B(亚型USH1B)和MERTK基因突变相关的视网膜色素变性等)。其它疾病包括年龄相关性黄斑变性,Leber遗传性视神经病变,青光眼,糖尿病黄斑水肿(DME)和黄斑毛细血管扩张2型。
除了RPE65基因治疗Leber先天性黑朦, 大部分眼科基因转移研究都还没有进入3期临床试验。通过腺相关病毒载体的视网膜下注射从而替代RPE65基因已经取得满意效果,能同时提高视力和改善视网膜功能。
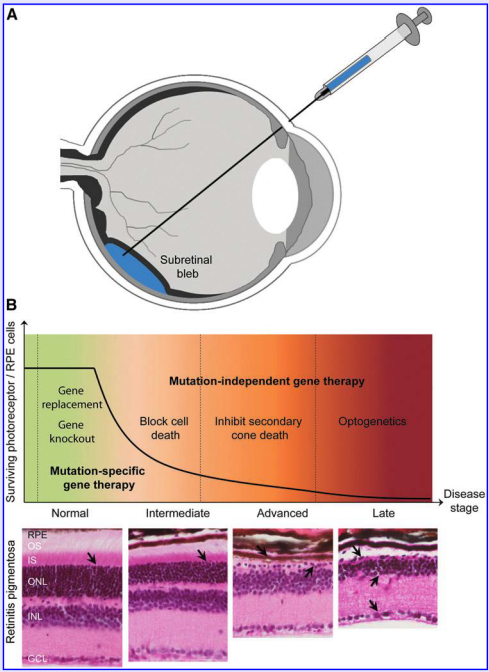
图1 用于治疗遗传性视网膜疾病的基因治疗方法
1. AAV可以用来构建眼科相关疾病的疾病模型
案例1:
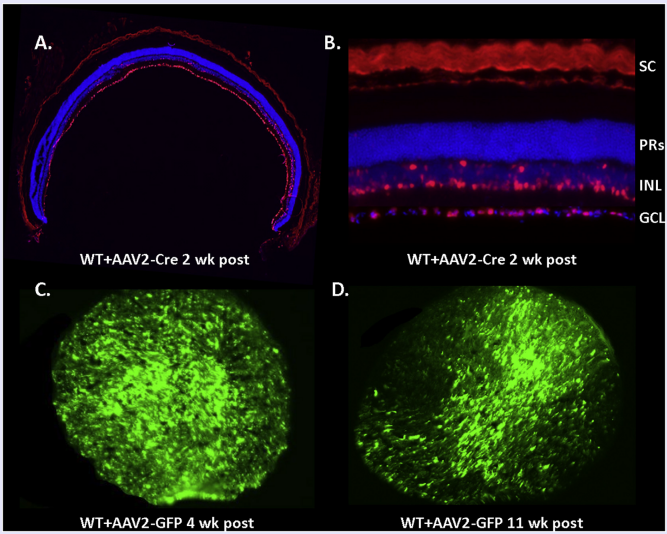
研究人员通过在老鼠视神经节细胞注射衣壳突变的AAV2携带CRE重组酶来构建组织特异性的Rosa26 (R26) 转基因小鼠,用来研究RGC退行性疾病以及视神经疾病。109的AAV病毒量就能够有效的感染鼠神经节细胞层神经元,并且可以持续表达长达11 weeks。 CRE的表达对RGC早期5 weeks内没有显著影响,但往后细胞会出现死亡。结果显示这项技术对于建立短期的疾病模型用于研究青光眼以及视神经相关疾病具有很好的应用价值。

案例2:
研究人员通过在SD大鼠视网膜下间隙注射携载有VEGF的AAV载体,诱导建立脉络膜新生血管(CNV)模型。VEGF在视网膜和视网膜色素上皮细胞可持续表达20个月,有利于模拟视网膜变性疾病的慢性病理过程。组织切片观察显示强烈的视网膜下新生血管的形成,光感受器变性以及色素上皮增殖,CNV的生成率达95%。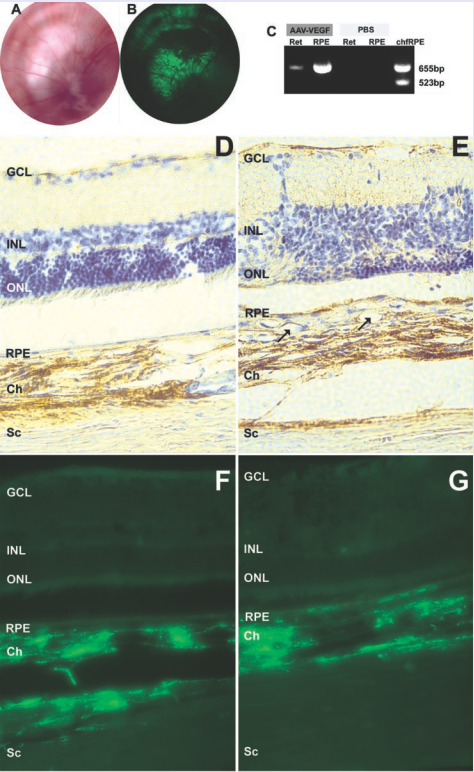
图4 SD大鼠眼感染了AAV-VEGF和AAV-GFP后15个月检测VEGF和GFP的表达
2. AAV介导的基因替代疗法
案例1:
早在2001年研究人员通过将rAAV2-RPE65注入RPE65基因敲除狗的视网膜下腔, 成功的恢复了狗的视力。
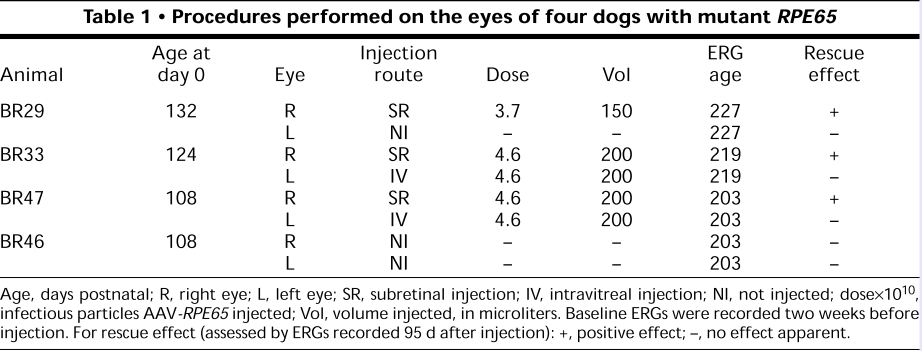
图6 四只RPE65突变的转基因狗进行基因治疗的具体过程与信息
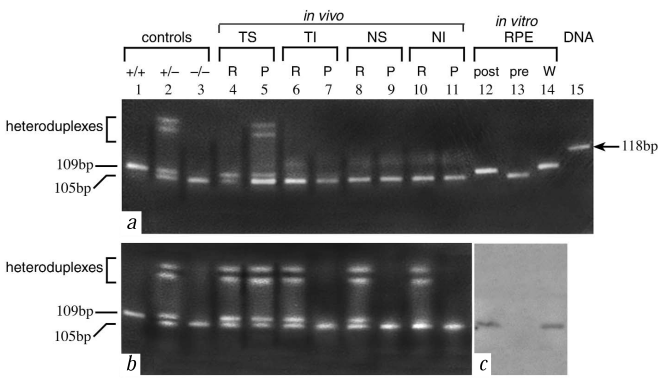
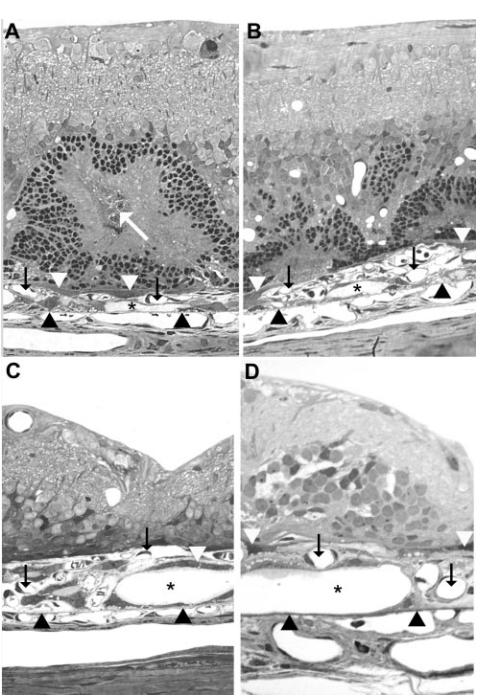
图7 体外导入的PRE65基因在神经视网膜(R)和RPE/脉络膜(RPE)以及体内导入的PRE65基因在RPE细胞中均能持久表达
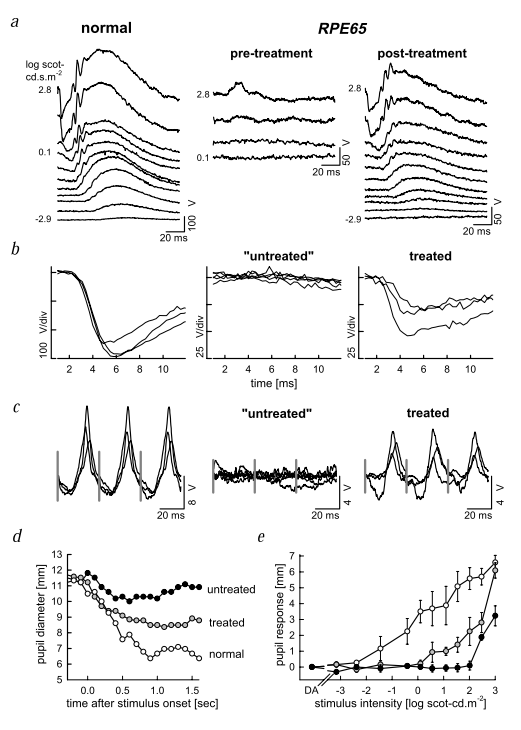
图8 通过视网膜注射AAV-RPE65改善了RPE65突变狗的视网膜和视功能
案例2:
Dalkara等建立一种AAV的变体ShH10,通过视网膜色素变性小鼠模型,以玻璃体内注射的给药方式靶向神经胶质细胞,产生高水平的胶质源性神经营养因子(GDNF),对其功能改善可维持长达5个月。
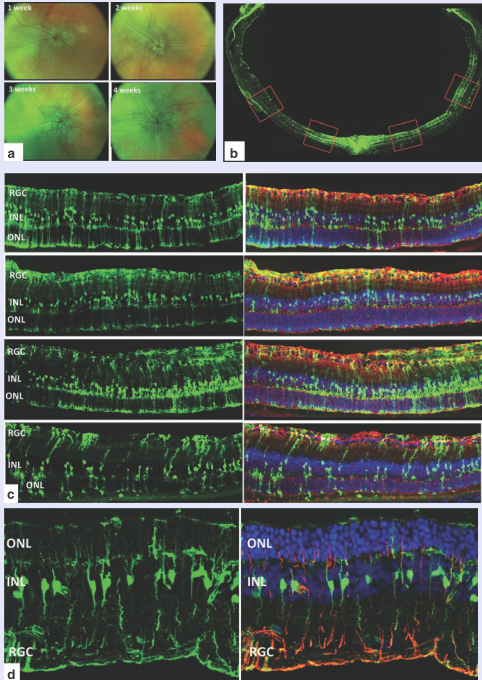
3. AAV在眼科疾病中介导的基因干扰或基因编辑
案例1:
老年黄斑变性(AMD)会影响视网膜病变,导致视力模糊扭曲,还会导致视野中央出现黑点。CRISPR-Cas9能够在基因中的特定位置进行精准地剪切和修复。研究团队成功地将CRISPR-Cas9注射到患湿性老年黄斑变性的小鼠眼中,并修改了VEGF基因。他们通过观察脉络膜新生血管(CNV)的方式监控眼部疾病进程,CNV是视网膜和巩膜之间新形成的血管,它是湿性黄斑变性的常见问题,研究人员发现,CNV区域减少了58%。此外,锥体机能不良的副作用只持续了3天,在治疗后一个星期后没有再出现。
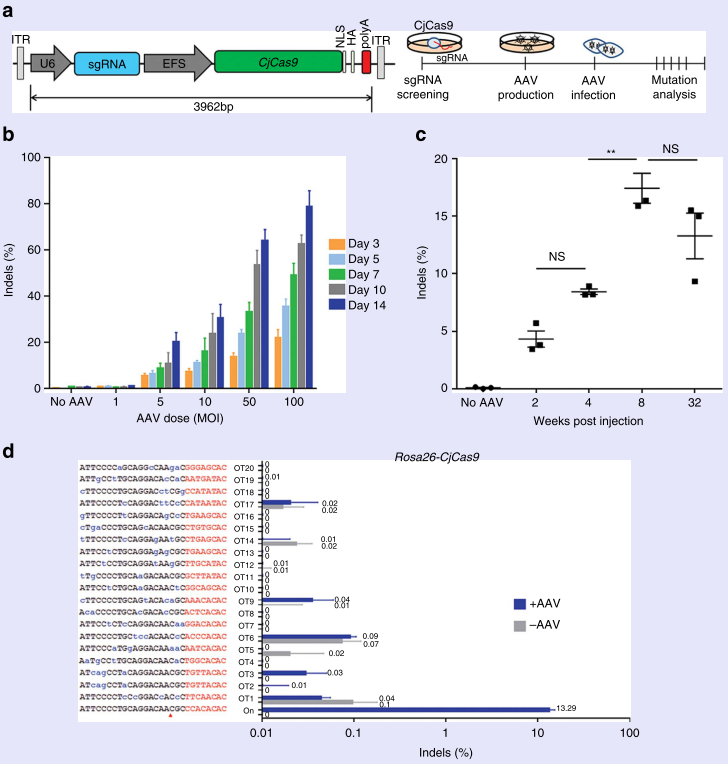
图10 AAV 携带的CjCas9 和 sgRNA以及介导的体内以及体外突变
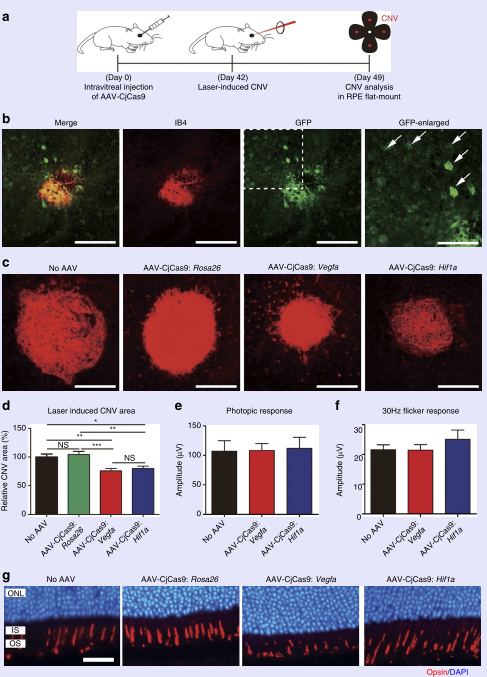
图11 AAV表达的外源cjCas9靶向Vegfa和Hif1a减少了激光诱导的脉络膜新生血管区域
案例2:
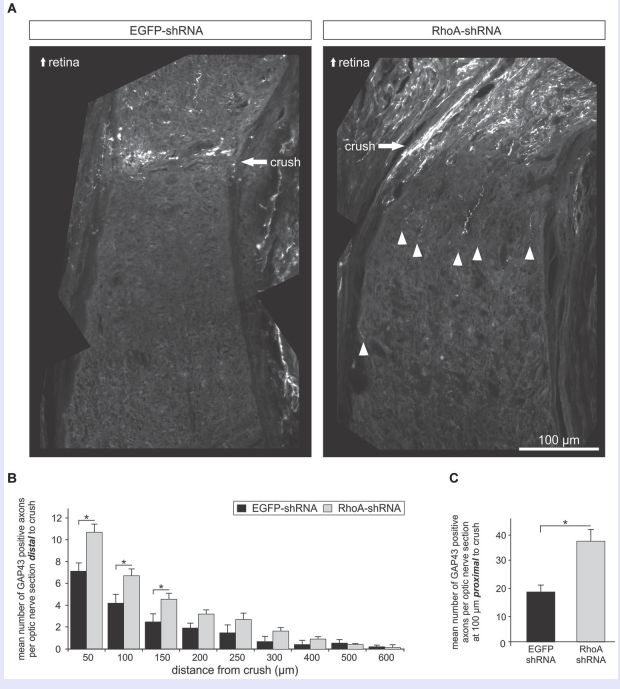
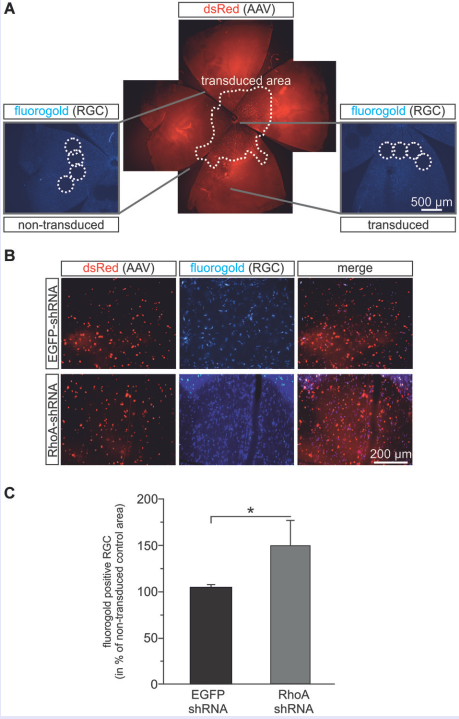
RhoA是MAPK上游的重要信号转导分子,参与细胞骨架、粘附的调控以及多条信号通路。Koch等采用大鼠视神经夹伤模型,玻璃体内注射AAV-RhoA-shRNA, RhoA表达下调,RGCs存活率及轴突再生能力显著提高。
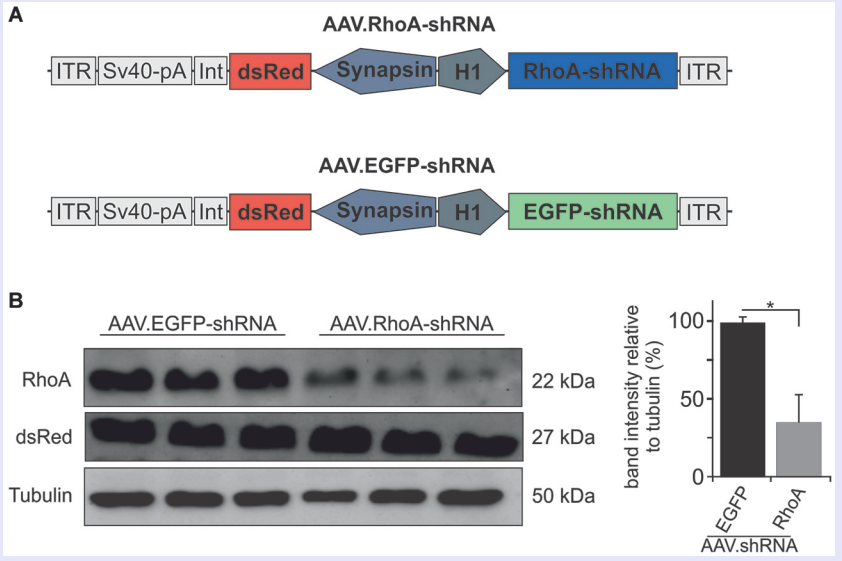
图12 AAV-RhoA-shRNA的载体结构图及体外表达显著下调RohA的蛋白表达水平
4. AAV用于解析眼科疾病发病机理
案例1:
SOCS-3是细胞因子信号转导抑制蛋白,对多种细胞因子和激素产生的信号转导过程进行负调节。孙等将PTENf/F/SOCS3f/f小鼠视神经夹伤,玻璃体注射AAV-Cre同时敲除PTEN和SOCS3基因,并向玻璃体中添加外源性睫状神经营养因子CNTF,再生的轴突可生长到上丘,并增加了RGCs的存活。
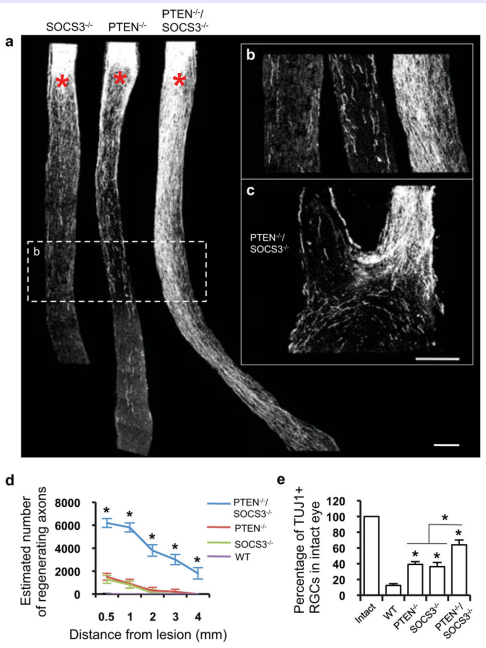
图15 通过注射AAV-cre后敲除PTEN和SOCS3基因,在视损失后4周观察到PTEN和SOCS3基因对于轴突再生具有协调作用
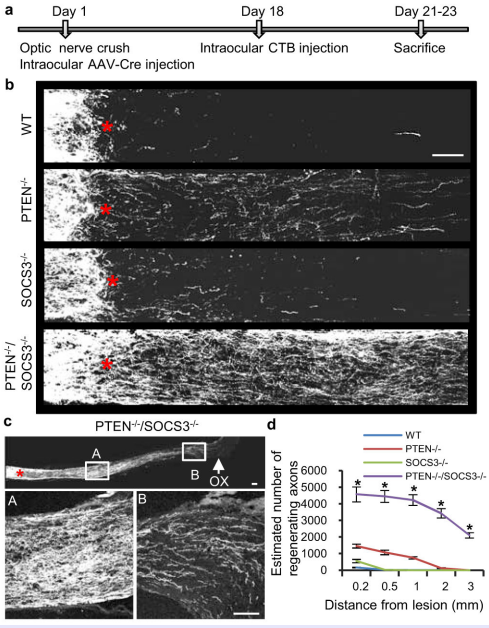
图16 通过注射AAV-cre后敲除PTEN和SOCS3基因,对于视神经的再生具有协调作用且以一种延迟处理的模式进行表达
5. AAV应用于临床试验
案例1:
力损害、眼球震颤及异常的眼底表现等;小部分患者发病年龄稍晚,以夜盲为主要表现,也称早发严重视网膜营养不良(severe early-childhood-onset retinal dystrophy, SECORD)。RPE65基因突变在LCA中占到6%~16%,SECORD中占到约2%,RPE65基因替代疗法已经在鼠类和犬类中试验成功。该研究则是将表达RPE65基因的重组腺相关病毒(adeno-associated virus, AAV)载体视网膜下注射以观察其安全性和有效性。
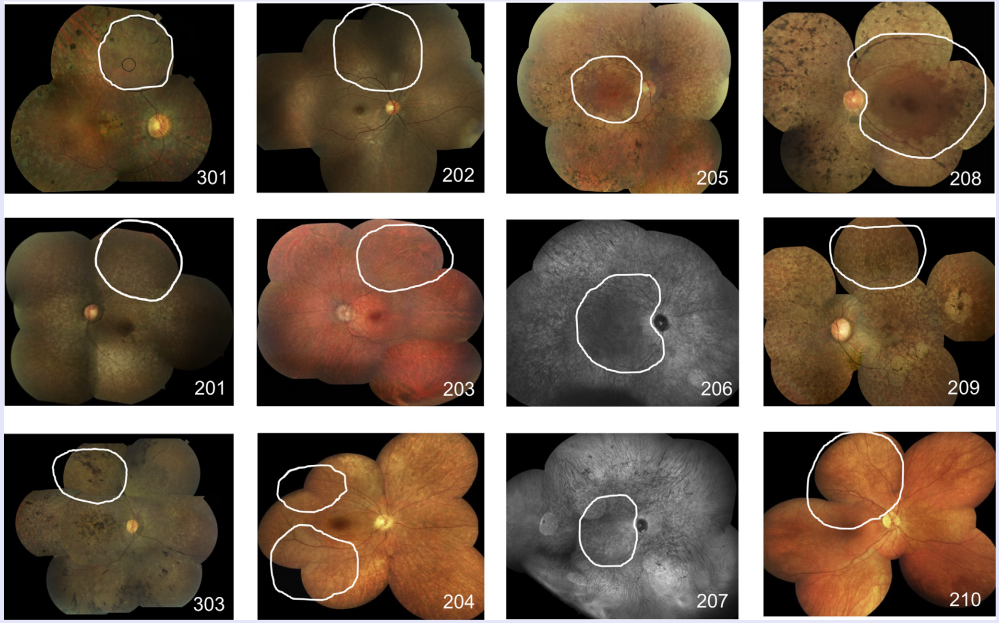
图17 12名患者表达RPE65基因的AAV视网膜下注射位置
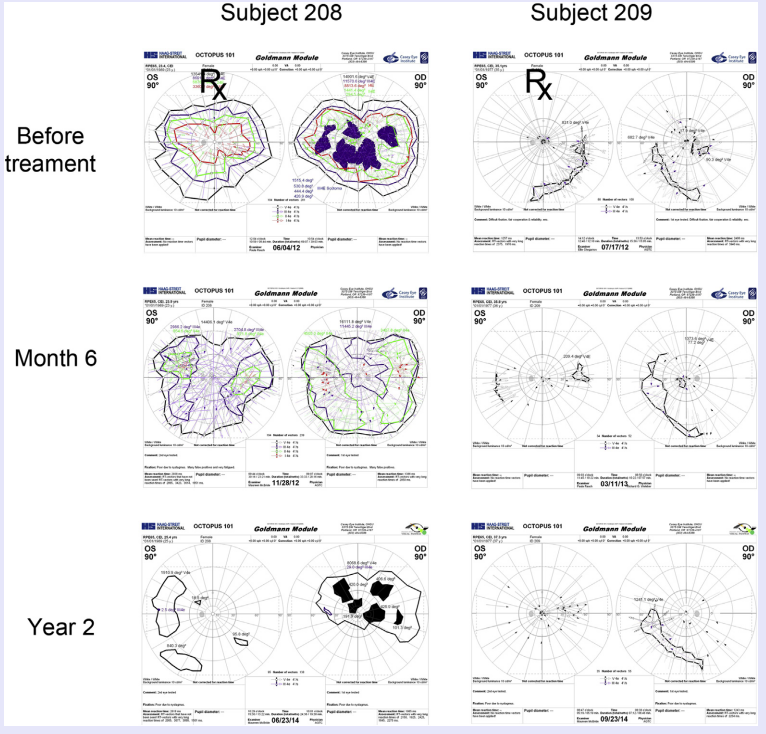
图18 208、209号患者治疗前后动态视野检查变化情况,目标眼用Px标注,可见盲点范围缩小和阈值敏感度提高
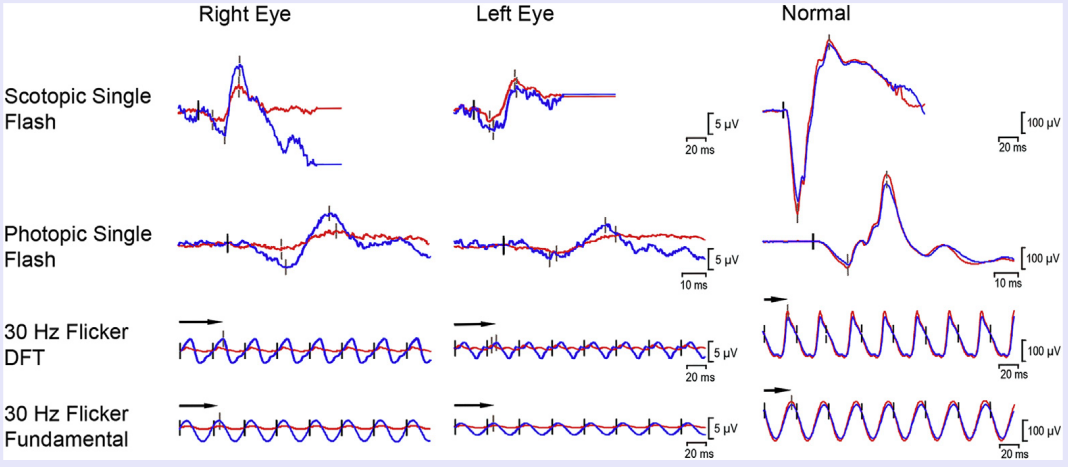
图19 204号患者治疗前后ERG变化情况,目标眼为右眼,红色为治疗前,蓝色为治疗后

| 启动子名称 |
特性 |
| CMV |
广谱性启动子 |
| CBA |
广谱性启动子 |
| CAG |
强启动子,广谱性启动子 |
| Rpe65 |
RPE--视网膜色素上皮层特异性表达 |
| VMD2 |
RPE--视网膜色素上皮层特异性表达 |
| RPGR |
RPE--视网膜色素上皮层特异性表达 |
| IRBP |
Photoreceptor --感光细胞特异性表达 |
| hGRK1 |
Photoreceptor --感光细胞特异性表达 |
| CAR |
Cone--视椎细胞特异性表达 |
| RHO |
Rod--视杆细胞特异性表达 |
| Grm6 |
bipolar -双极细胞特异性表达(常用于光遗传学靶点) |
| GFAP |
穆勒神经胶质细胞特异性表达 |
| human connexin 36 |
黄斑中心凹双极神经节细胞特异性表达 |
| U6 |
基因编辑 |
目前应用于眼部基因转移的AAV至少有9种血清型,它们主要区别在衣壳蛋白的不同,并因此导致各种血清型AAV对不同的组织和细胞有不同的感染效率。
无论在大鼠视网膜下或玻璃体内注射AAV1, AAV2, AAV5载体均可有效转染光感受器细胞和视网膜色素上皮细胞。
AAV2, AAV5表达部位位于光感受器细胞和视网膜色素上皮细胞,而AAV1则特异集中于视网膜色素上皮细胞层。
AAV5在视网膜的表达早于AAV2,并且感染效率和表达水平要高于AAV2约30倍左右。
AAV2/9载体能有效转染Muller细胞, AAV2/7载体和AAV2/8载体对小鼠光感受器的转染效率比AAV2/5高6~8倍。
AAV1载体和AAV8载体对兔或人角膜上皮的转染效率高于AAV2, AAV5和AAV7。
[1]Jacobson SG, Cideciyan AV, Ratnakaram R, et al., Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 2012 Jan;130(1):9-24. doi: 10.1001/archophthalmol.2011.298.
[2]Maguire AM, High KA, Auricchio A, et al., Age-dependent effects of RPE65 gene therapy for Leber's congenital amaurosis: a phase 1 dose-escalation trial. Lancet. 2009 Nov 7;374(9701):1597-605. doi: 10.1016/S0140-6736(09)61836-5.
[3]Weleber RG, Pennesi ME, Wilson DJ, et al., Results at 2 Years after Gene Therapy for RPE65-Deficient Leber Congenital Amaurosis and Severe Early-Childhood-Onset Retinal Dystrophy. Ophthalmology. 2016 Jul;123(7):1606-20. doi: 10.1016/j.ophtha.2016.03.003.
[4]Langouet-Astrie CJ, Yang Z, Polisetti SM, et al., Characterization of intravitreally delivered capsid mutant AAV2-Cre vector to induce tissue-specific mutations in murine retinal ganglion cells. Exp Eye Res. 2016 Oct;151:61-7. doi: 10.1016/j.exer.2016.07.019.
[5]Katada Y, Kobayashi K, Tsubota K, Kurihara T. Evaluation of AAV-DJ vector for retinal gene therapy. PeerJ. 2019 Jan 17;7:e6317. doi: 10.7717/peerj.6317.
[6]Boye SE, Alexander JJ, Witherspoon CD, et al., Highly Efficient Delivery of Adeno-Associated Viral Vectors to the Primate Retina. Hum Gene Ther. 2016 Aug;27(8):580-97. doi: 10.1089/hum.2016.085.
[7]Ha Y, Liu W, Liu H, Zhu S, Xia F, Gerson JE, Azhar NA, Tilton RG, Motamedi M, Kayed R, Zhang W. AAV2-mediated GRP78 Transfer Alleviates Retinal Neuronal Injury by Downregulating ER Stress and Tau Oligomer Formation. Invest Ophthalmol Vis Sci. 2018 Sep 4;59(11):4670-4682. doi: 10.1167/iovs.18-24427.
[8]Phatak NR, Stankowska DL, Krishnamoorthy RR. Bcl-2, Bcl-xL, and p-AKT are involved in neuroprotective effects of transcription factor Brn3b in an ocular hypertension rat model of glaucoma. Mol Vis. 2016 Aug 16;22:1048-61.
[9]Narfström K, Katz ML, Bragadottir R, Seeliger M, Boulanger A, Redmond TM, Caro L, Lai CM, Rakoczy PE. Functional and structural recovery of the retina after gene therapy in the RPE65 null mutation dog. Invest Ophthalmol Vis Sci. 2003 Apr;44(4):1663-72. doi: 10.1167/iovs.02-0595.
[10]Annear MJ, Bartoe JT, Barker SE, Smith AJ, Curran PG, Bainbridge JW, Ali RR, Petersen-Jones SM. Gene therapy in the second eye of RPE65-deficient dogs improves retinal function. Gene Ther. 2011 Jan;18(1):53-61. doi: 10.1038/gt.2010.111.
[11]Askou AL, Alsing S, Benckendorff JNE, et al., Suppression of Choroidal Neovascularization by AAV-Based Dual-Acting Antiangiogenic Gene Therapy. Mol Ther Nucleic Acids. 2019 Jun 7;16:38-50. doi: 10.1016/j.omtn.2019.01.012.
[12]O'Callaghan J, Crosbie DE, Cassidy PS, et al., Therapeutic potential of AAV-mediated MMP-3 secretion from corneal endothelium in treating glaucoma. Hum Mol Genet. 2017 Apr 1;26(7):1230-1246. doi: 10.1093/hmg/ddx028.
[13]Sato K, Shiga Y, Nakagawa Y, et al., Ecel1 Knockdown With an AAV2-Mediated CRISPR/Cas9 System Promotes Optic Nerve Damage-Induced RGC Death in the Mouse Retina. Invest Ophthalmol Vis Sci. 2018 Aug 1;59(10):3943-3951. doi: 10.1167/iovs.18-23784.
[14]Xia CH, Ferguson I, Li M, Kim A, Onishi A, Li L, Su B, Gong X. Essential function of NHE8 in mouse retina demonstrated by AAV-mediated CRISPR/Cas9 knockdown. Exp Eye Res. 2018 Nov;176:29-39. doi: 10.1016/j.exer.2018.06.026.
[15]Yu W, Mookherjee S, Chaitankar V, Hiriyanna S, Kim JW, Brooks M, Ataeijannati Y, Sun X, Dong L, Li T, Swaroop A, Wu Z. Nrl knockdown by AAV-delivered CRISPR/Cas9 prevents retinal degeneration in mice. Nat Commun. 2017 Mar 14;8:14716. doi: 10.1038/ncomms14716.
[16]Trapani I. Dual AAV Vectors for Stargardt Disease. Methods Mol Biol. 2018;1715:153-175. doi: 10.1007/978-1-4939-7522-8_11.
[17]Ramlogan-Steel CA, Murali A, Andrzejewski S, Dhungel B, Steel JC, Layton CJ. Gene therapy and the adeno-associated virus in the treatment of genetic and acquired ophthalmic diseases in humans: Trials, future directions and safety considerations. Clin Exp Ophthalmol. 2019 May;47(4):521-536. doi: 10.1111/ceo.13416.
[18]McClements ME, MacLaren RE. Gene therapy for retinal disease. Transl Res. 2013 Apr;161(4):241-54. doi: 10.1016/j.trsl.2012.12.007.
[19]Trapani I. Adeno-Associated Viral Vectors as a Tool for Large Gene Delivery to the Retina. Genes (Basel). 2019 Apr 9;10(4):287. doi: 10.3390/genes10040287.
[20]Petit L, Khanna H, Punzo C. Advances in Gene Therapy for Diseases of the Eye. Hum Gene Ther. 2016 Aug;27(8):563-79. doi: 10.1089/hum.2016.040.
[21]Schön C, Biel M, Michalakis S. Retinal gene delivery by adeno-associated virus (AAV) vectors: Strategies and applications. Eur J Pharm Biopharm. 2015 Sep;95(Pt B):343-52. doi: 10.1016/j.ejpb.2015.01.009.
[22]Ku CA, Pennesi ME. Retinal Gene Therapy: Current Progress and Future Prospects. Expert Rev Ophthalmol. 2015 Jun;10(3):281-299. doi: 10.1586/17469899.2015.1035711.
[23]Trapani I, Puppo A, Auricchio A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 2014 Nov;43:108-28. doi: 10.1016/j.preteyeres.2014.08.001.