武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
CRISPR-dCas9基因表达调控
询价
品牌商
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
过表达基因超过病毒载体容量怎么解?CRISPR/dCas9助力实现超大基因内源过表达
3166 人阅读发布时间:2023-08-04 11:13
一、原理、应用
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/Cas9)系统是目前被广泛运用的基因编辑系统,其原理是由CRISPR转录产生的sgRNA介导Cas9核酸酶靶向目标序列,对序列进行切割。Cas9的核酸酶剪切活性取决于两个结构域:RuvC和HNH。当这两个结构域同时处于失活状态时,Cas9将不具有核酸酶活性,成为dCas9(dead Cas9)。CRISPR-dCas9系统即是dCas9与转录激活因子(如VP64、VPR、SAM或SunTag)或转录抑制因子(如KRAB)融合后,结合sgRNA能促进或抑制目的基因的表达。CRISPR-dCas9系统是通过激活或抑制细胞内源基因表达来提高或抑制目标基因的表达量,它不需要转入外源DNA,操作更简易。此系统可在同一个启动子上设计多个sgRNA来提高或抑制基因的转录活性,目的基因的转录本也会覆盖的更全面。
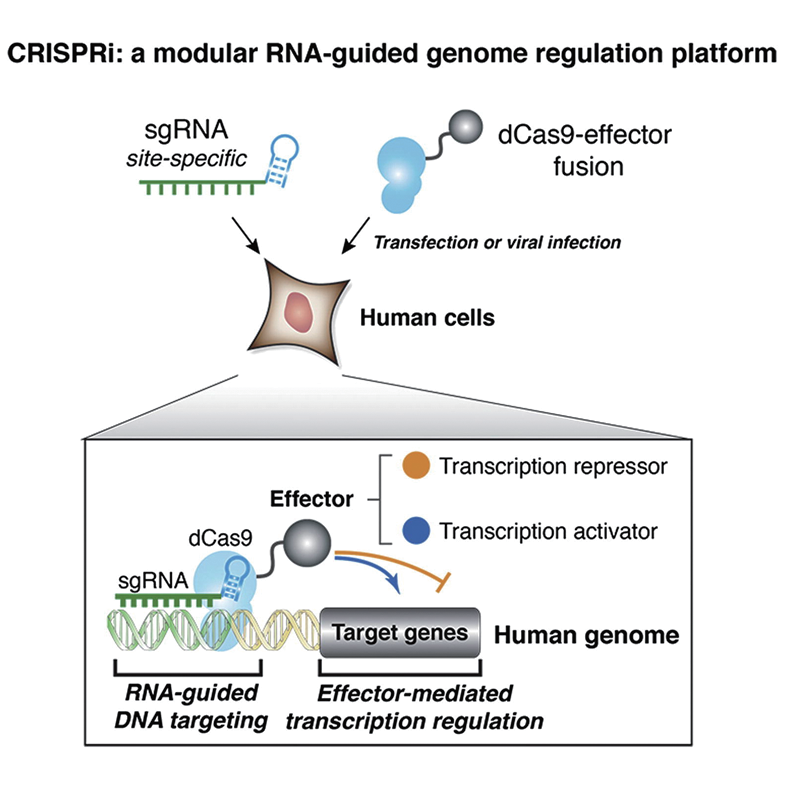
图1. CRISPR-dCas9系统调控内源基因转录激活与抑制(Gilbert LA, et al., Cell, 2013)
基因敲低(CRISPRi)和基因敲除(CRISPRn)效率的比较
Mandegar等人通过比较Tet-on调控dCas9-KRAB的基因敲低(CRISPRi)与Tet-on调控Cas9的基因敲除(CRISPRn),发现CRISPRi对NANOG的抑制效果更快且更完全。主要是由于CRISPRn的敲除存在很大的效率问题,在iPS细胞系中NANOG有抑制的仅60%–70%的细胞,而CRISPRi能达到99%以上。
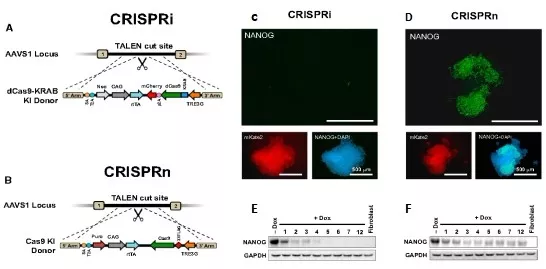
图2. 基因敲低(CRISPRi)和基因敲除(CRISPRn)效率的比较(Mandegar MA, et al., cell stem cell, 2016, modified)
dCas9-VPR能显著提高内源性基因的表达
Chavez等人将dCas9与三种激活因子VP64-P65-Rta(VPR,VP64:疱疹病毒转录因子,P65:NFкB信号通路的成员,Rta:EB病毒激活因子)融合,通过特异性靶向目的基因的sgRNA能特异性的提高内源性基因(MIAT、NEUROD1、ASCL1和RHOXF2)的转录水平,起到激活基因的目的。与dCas9-VP64相比效果更加显著。
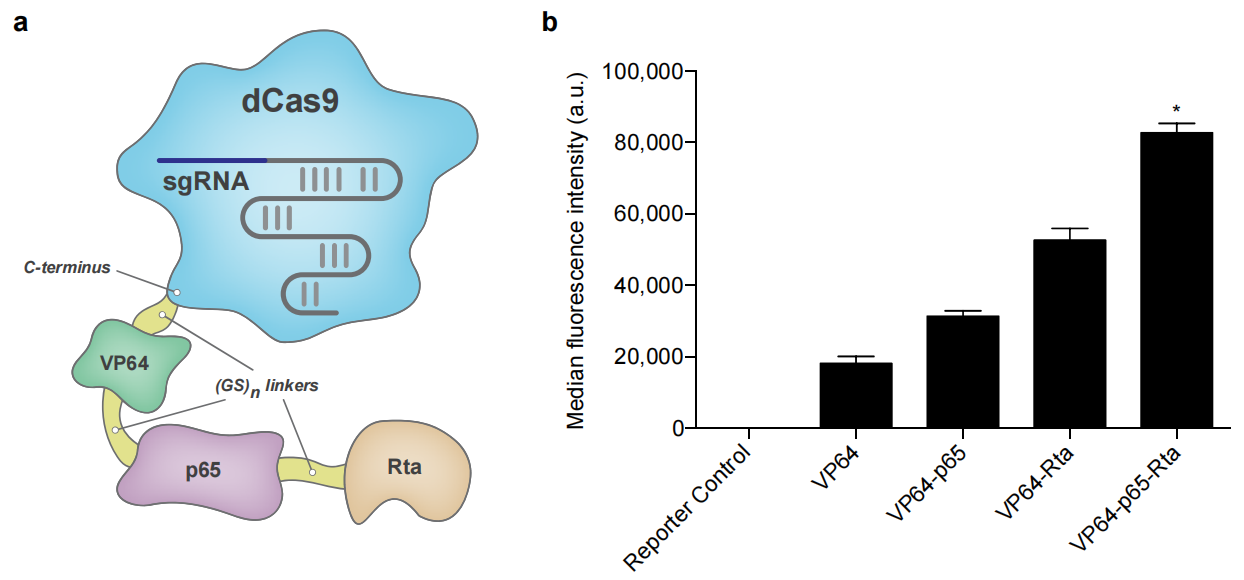
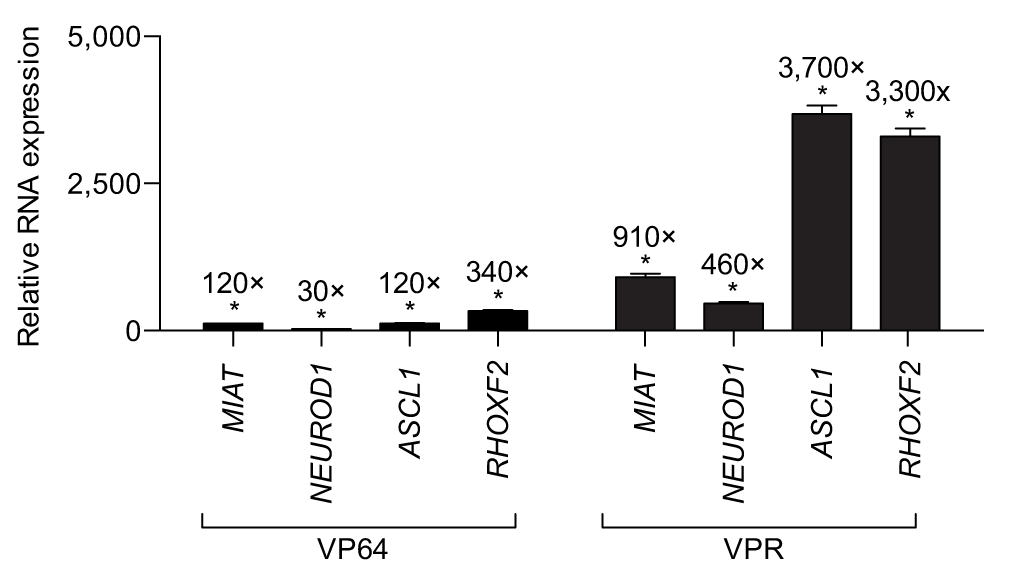
图3. dCas9-VPR能显著提高内源性基因的表达(Chavez A, et al., Nature methods, 2015)
二、服务
CRISPR-dCas9转录激活可实现目的基因在内源环境中过表达、诱导iPSC、激活沉默基因、遗传缺陷补偿等。CRISPR-dCas9转录抑制可实现抑制目的基因表达、分析代谢途径、敲低特定基因转录量以研究基因功能、可与CRISPR/Cas9 Gene Knockout或RNAi技术联合作用等。枢密科技提供病毒载体包装及细胞系构建服务。服务流程
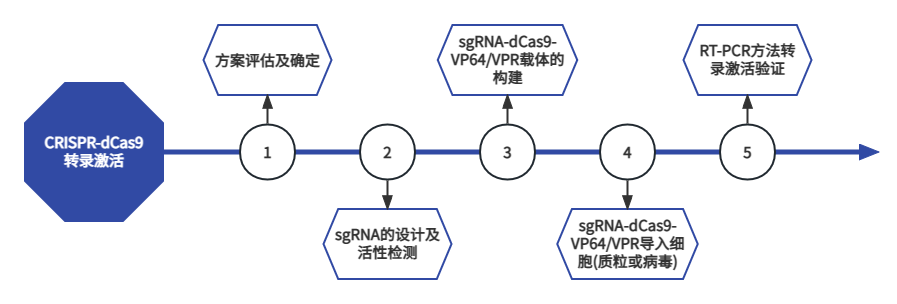
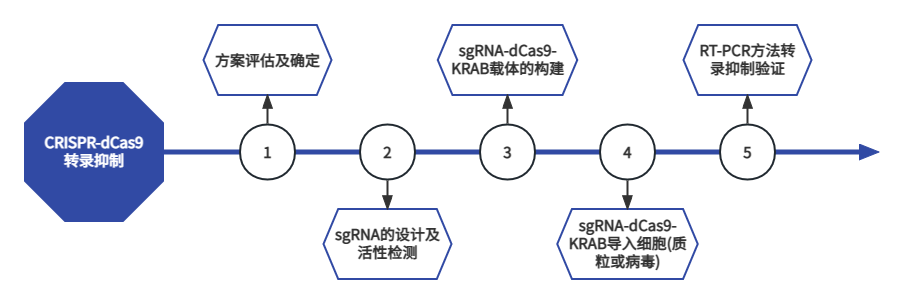
客户提供内容/材料
1、目的基因基因序列(序列/ID)以及物种来源;
2、需介导转录激活或抑制的细胞(可选);
3、病毒类型选择以及要求;
4、血清型选择;
服务信息及最终交付内容、产品
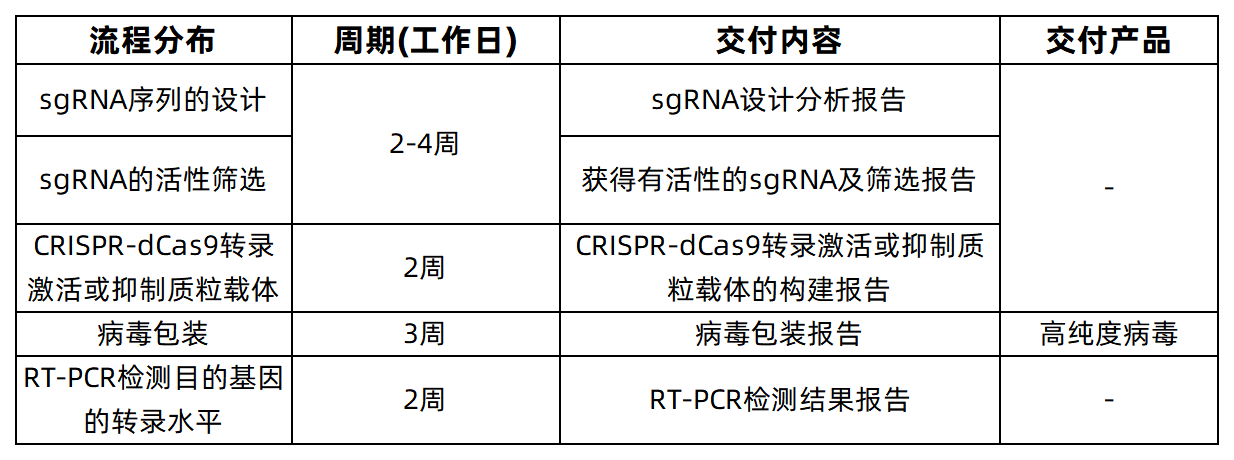
参考文献:
1.Gilbert LA, Larson MH, Morsut L, et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 2013 Jul 18;154(2):442-51.
2.Mandegar MA, Huebsch N, Frolov EB, et al. CRISPR Interference Efficiently Induces Specific and Reversible Gene Silencing in Human iPSCs. Cell Stem Cell. 2016 Apr 7;18(4):541-53.
3.Chavez A, Scheiman J, Vora S, et al. Highly efficient Cas9-mediated transcriptional programming. Nat Methods. 2015 Apr;12(4):326-8.
部分客户文章
IF=38.079【客户文章】Cell Discov.:复旦脑科学研究院黄志力团队发现REM睡眠终止的神经环路机制
IF=31.37【客户文章】Cell Metabolism:南京鼓楼医院毕艳团队发现脂肪-大脑间通讯促进糖尿病认知功能障碍新机制
IF=66.85【客户文章】Cell:中科大薛天教授团队揭示光感知调控血糖代谢的神经机制
IF=28.771【客户文章】Nat Neurosci:南京大学闫超教授揭示脂堆积的反应性星形胶质细胞促进癫痫疾病进展的机制
IF=38.104【客户文章】STTT:厦大团队联合重医研究组揭示APOE调控新冠病毒进入细胞的分子机制
如有相关需求,或了解其他产品和服务,欢迎咨询我们!
点击进入店铺,查看更多产品和服务