武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
AAV/Lentivirus介导基因过表达及RNA干扰服务
询价
品牌商
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
Science 转化医学快讯|AAV基因治疗恢复IPSC和小鼠PD模型多巴胺转运体的表达,并改善病理表型
755 人阅读发布时间:2023-06-14 09:44
编者按
著名作家巴金、美国前总统杜鲁门等众多名人都得过帕金森病,帕金森病是一种常见的神经系统性疾病。据世界卫生组织(WHO)预测,到2040年神经退行性疾病将取代癌症成为人类第二大致死疾病。更令人难受的是,神经退行性疾病的新药研发道路遍布坎坷崎岖。 小编在这里给大家推荐英国伦敦大学学院Simon N. Waddington带领的实验团队于5月20日发表在《Science Translational Medicine》的文章,研究人员将DTDS(多巴胺转运体缺陷综合征)患者皮肤的成纤维细胞重编程为人诱导多功能干细胞(iPSC),然后诱导分化建立DTDS的mDA神经元模型,该模型能表现出明显的DAT(多巴胺转运体)活性受损,肿瘤坏死因子α介导炎症相关的细胞凋亡性神经退行性病变,以及多巴胺毒性。利用突变特异性的药物伴侣pifithrin-μ能部分恢复DAT活性,慢病毒表达野生型人SLC6A3互补DNA可恢复DAT的活性,阻碍所有患者来源的mDA细胞系的神经退行性病变。为了推动临床转化进展,研究人员使用敲除小鼠DTDS模型来复制人类疾病,表现出帕金森病特征,包括震颤,运动迟缓和过早死亡。利用腺相关病毒(AAV)载体表达人SLC6A3基因,并在新生DTDS模型小鼠侧脑室注射可提供人类DAT的神经元表达,从而改善了小鼠的运动表型、生存期及黑质和纹状体内神经元的存活,尽管在高剂量时出现了非靶向神经毒性作用。成年敲除小鼠中脑立体定位注射AAV2.SLC6A3的基因治疗可避免上述问题,挽救了运动表型和神经退行性病变,提示靶向性AAV基因治疗对DTDS患者可能有效,给患者带来了福音和曙光,并为相关神经退行性疾病的研究提供了良好的研究范式和临床转化策略。

研究背景
大多数遗传性神经退行性疾病是无法治愈的,通常只能进行姑息治疗。但随着基础研究的深入,有针对性的精准医学治疗策略正在成为改善神经退行性疾病的有力武器。多巴胺转运体缺乏综合征(DTDS)由SLC6A3的双等位基因功能缺失突变引起,编码多巴胺转运体(DAT)。患者表现为早期婴儿运动障碍,严重进行性儿童帕金森病和脑脊液多巴胺代谢物升高,缺乏有效的治疗和无情的疾病进程常导致患者孩童时期的死亡,从而严重阻碍了DTDS的治疗进展。目前对于介导DTDS的具体机制以及疾病的治疗仍知之甚少。实验结果
1.DTDS患者的中脑多巴胺(mDA)神经元的DAT活性下调
首先研究人员将DTDS患者皮肤的成纤维细胞重编程为人诱导多功能干细胞(iPSC),然后诱导分化建立DTDS的mDA神经元模型,发现DTDS患者mDA神经元的DAT活性显著降低,神经元摄取的DA显著减少,并且DAT的失活影响mDA神经元多巴胺的稳态。
2. DTDS患者的mDA神经元的多巴胺合成关键酶功能降低
接着研究DAT功能障碍对多巴胺合成关键酶的影响,发现DTDS患者的mDA神经元酪氨酸羟化酶(TH)、单胺氧化酶A和B(MAOA/B)蛋白表达明显降低,而芳香族氨基酸脱羧酶(AADC)表达无显著变化。
3. mDA神经元的DAT功能异常导致神经元凋亡
研究人员发现DTDS患者诱导出来的神经元数量显著低于健康人诱导出来神经元的数量,荧光标记发现是TH阳性神经元数量显著减少。标记凋亡分子caspase3的免疫荧光发现DTDS诱导出的mDA神经元凋亡分子显著增加,说明DAT功能障碍诱导mDA神经元的凋亡。
4.暴露于炎症因子和多巴胺环境导致DTDS的mDA神经元发生程序性死亡
进一步研究神经元凋亡的机制,发现向培养的mDA神经元中加入脂多糖(LPS)或者多巴胺(DA)均不能诱导神经元凋亡。但是向DTDS诱导的mDA神经元加入IL-1和TNF-α,并加入DA共同处理时,DTDS诱导的mDA神经元caspase3表达明显增加,说明炎症因子和DA协同作用诱导细胞发生程序性死亡。
5.药理学和基因治疗改善DTDS的mDA神经元的DAT功能障碍
接着研究人员研究DTDS的治疗策略,首先采用药理学手段,向DTDS诱导的mDA神经元中加入热休克蛋白70抑制剂pifithrin-μ,发现患者1的DTDS诱导的mDA神经元DAT的活性明显增加。接着研究人员开发了一种基因治疗方案,将正常人的SLC6A3基因导入DTDS诱导的mDA神经元,发现在患者1和患者2的DTDS-mDA神经元DAT的活性明显增加,并发现TH阳性神经元数量明显增多。
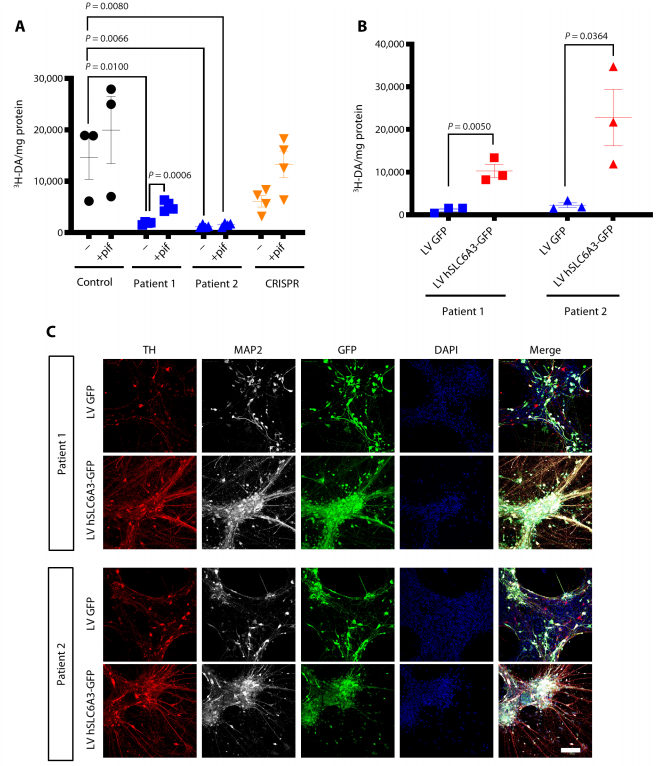
Figure1. DTDS患者的培养mDA神经元的慢病毒基因治疗
6.AAV基因治疗改善DAT敲除小鼠的DAT功能障碍
为了将治疗方案临床转化,研究人员构建了表达人SLC6A3的重组AAV2载体,将病毒注射到新生DAT功能障碍小鼠的黑质脑区,发现AAV重组病毒治疗能恢复DAT的表达,明显提高小鼠的生存率,改善小鼠的运动障碍。但同时研究也发现高剂量时出现了非靶向神经毒性作用。而成年DAT功能障碍小鼠中脑注射AAV9可完美解决这个问题,并能达到同样的恢复DAT表达、增加TH阳性神经元数量及改进运动障碍的目的,从而最终提高小鼠的生存期。
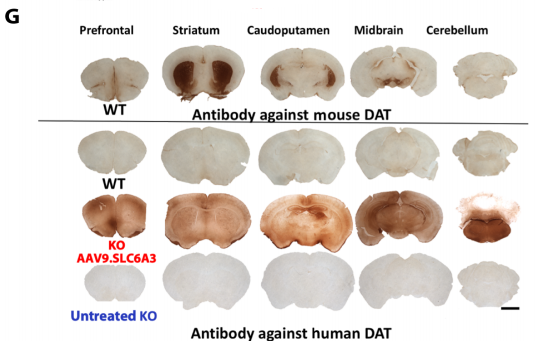
Figure2.1 新生DAT基因敲除小鼠侧脑室AAV9基因治疗
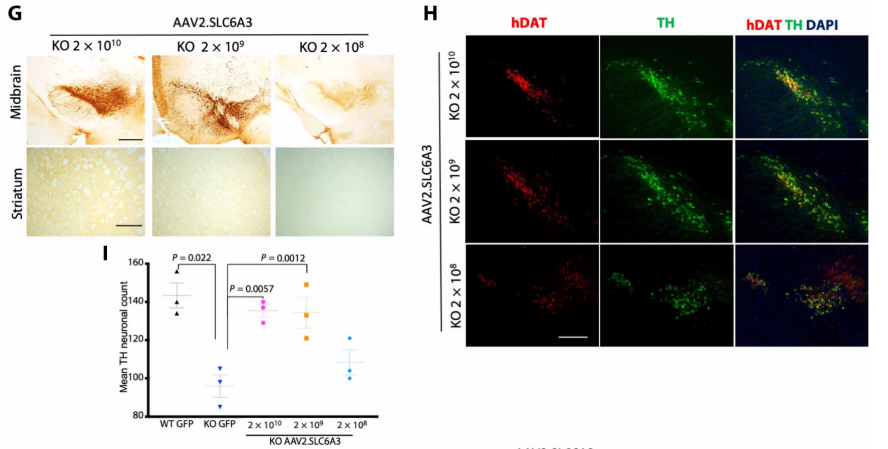
Figure2.2 成年DAT基因敲除小鼠中脑AAV2基因治疗
徐老师点评:
本文作者将DTDS患者皮肤的成纤维细胞重编程为iPSC,并诱导分化为mDA神经元,通过生化检测、免疫荧光、药理学与基因治疗的研究手段,发现mDA神经元出现DAT功能障碍,炎症因子和多巴胺协同作用能介导mDA神经元退行性病变。体外培养的mDA神经元的慢病毒基因治疗以及基因敲除小鼠中AAV基因治疗均表明能明显改善DAT功能障碍小鼠的相关表型(DAT活性、TH阳性神经元数目及运动障碍)。本研究为DTDS等神经退行性疾病的研究提供了良好的研究范式和临床转化策略。