武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
抑制神经元活性Kir2.1:rAAV-hSyn-Kir2.1-EGFP
¥3980
品牌商
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
研究发现LHb抑制性神经元的食欲素信号调控雄性小鼠的攻击行为
2536 人阅读发布时间:2023-06-14 09:22
精神分裂症患者的攻击暴力行为常常威胁到社会、家庭成员人身安全。除了精神分裂症以外,自闭症谱系障碍、注意力缺陷多动障碍、也存在严重的攻击行为。在动物中更有意思的是雄性小鼠发现统治低等动物是有回报的,因此它们更加偏爱攻击行为,以获得更高等级的社会地位。
LHb(外侧缰核)是人类和非人类动物奖赏神经环路中的关键脑区,激活后主要通过间接抑制中脑多巴胺神经元来促进负性情绪。最.新研究表明LHb可能在调控攻击行为中发挥重要作用。
 2020年4月西奈山伊坎医学院Scott J. Russo研究团队在Nature Neuroscience杂志上发表文章LHb抑制性神经元的食欲素信号调控攻击行为。
2020年4月西奈山伊坎医学院Scott J. Russo研究团队在Nature Neuroscience杂志上发表文章LHb抑制性神经元的食欲素信号调控攻击行为。
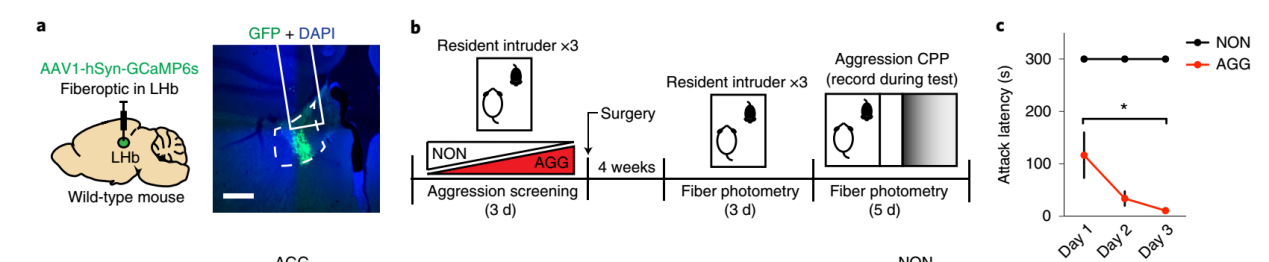
研究人员做了一个很有意思的实验:筛选具有攻击性和无攻击性的CD1小鼠,同时向CD1小鼠的LHb脑区注射AAV-GCaMP6后通过光纤钙成像记录系统发现具备攻击性CD1小鼠在撕咬C57小鼠过程中LHb神经元活动降低,而无攻击性CD1小鼠在和C57小鼠接触过程中LHb神经元活动增强。这与之前光抑制LHb神经元促进攻击行为保持一致。
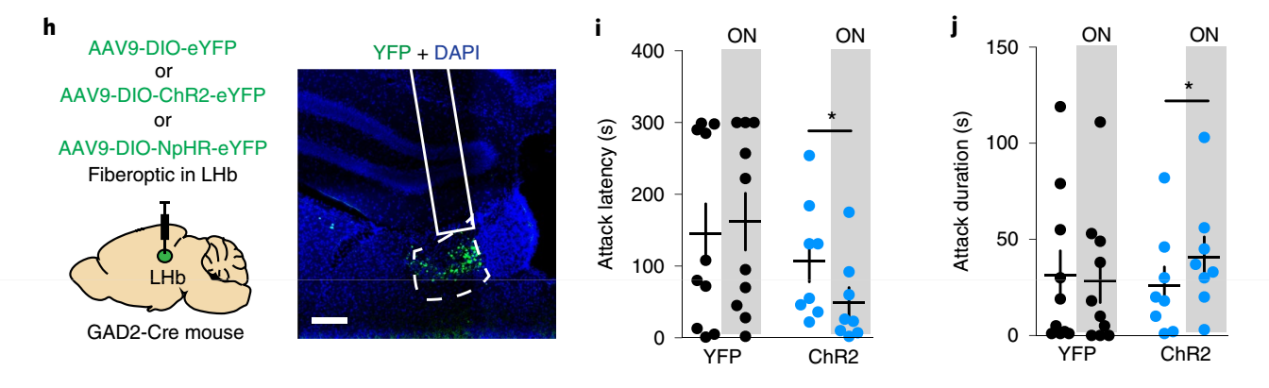
在LHb注射光遗传学病毒AAV-DIO-ChR2,激活 GAD2神经元后小鼠的攻击行为潜伏时间缩短,攻击性行为持续时间增加,表明攻击性行为增强. 抑制该脑区GAD2神经元,尽管并不能阻断攻击行为,但在一定程度上减弱攻击行为,具体表现为攻击行为的潜伏期延长,攻击的总时间减少。
食欲素(OxR2)神经元细胞体仅位于下丘脑外侧(LH),但是可以投射到僵核。食欲素之前尚未报道参与攻击行为,但参与药物成瘾、社交行为等多种行为。
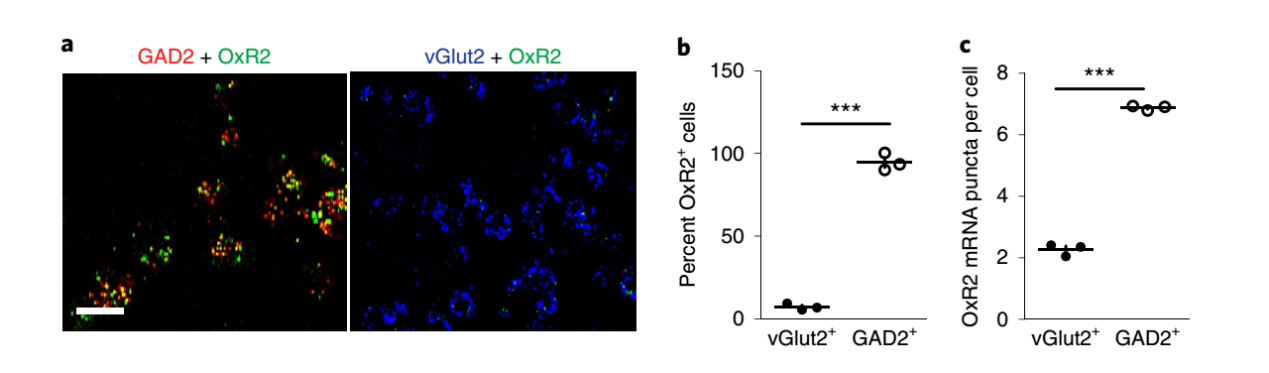
那么OxR2是否介导LHb脑区调控攻击行为呢?首先,实验证明:几乎所有的GAD2神经元表达OxR2,而不到10%的vGlut2神经元表达OxR2。其次,在连续3天的攻击行为后LHb脑区GAD2神经元表达OxR2增加。这些结果从某种程度上来说可以说明OxR2信号参与攻击行为。
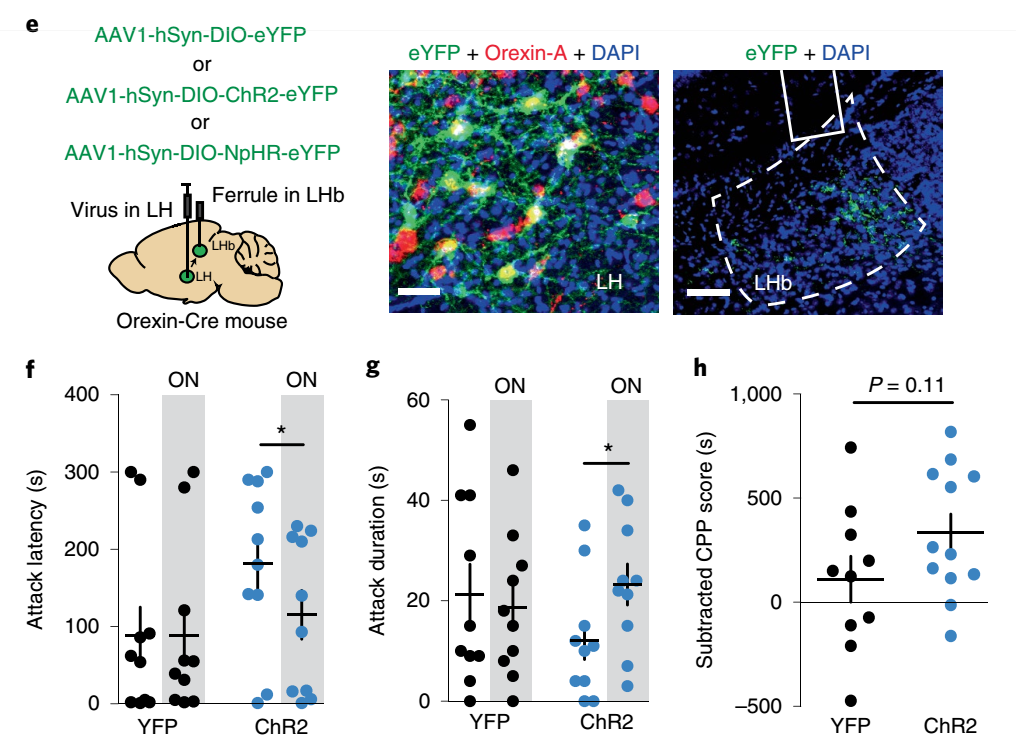
图5 激活LHb脑区OxR2神经元促进攻击

LHb(外侧缰核)是人类和非人类动物奖赏神经环路中的关键脑区,激活后主要通过间接抑制中脑多巴胺神经元来促进负性情绪。最.新研究表明LHb可能在调控攻击行为中发挥重要作用。


图1,通过光纤记录系统观察攻击过程中僵核的神经元活性
研究人员做了一个很有意思的实验:筛选具有攻击性和无攻击性的CD1小鼠,同时向CD1小鼠的LHb脑区注射AAV-GCaMP6后通过光纤钙成像记录系统发现具备攻击性CD1小鼠在撕咬C57小鼠过程中LHb神经元活动降低,而无攻击性CD1小鼠在和C57小鼠接触过程中LHb神经元活动增强。这与之前光抑制LHb神经元促进攻击行为保持一致。

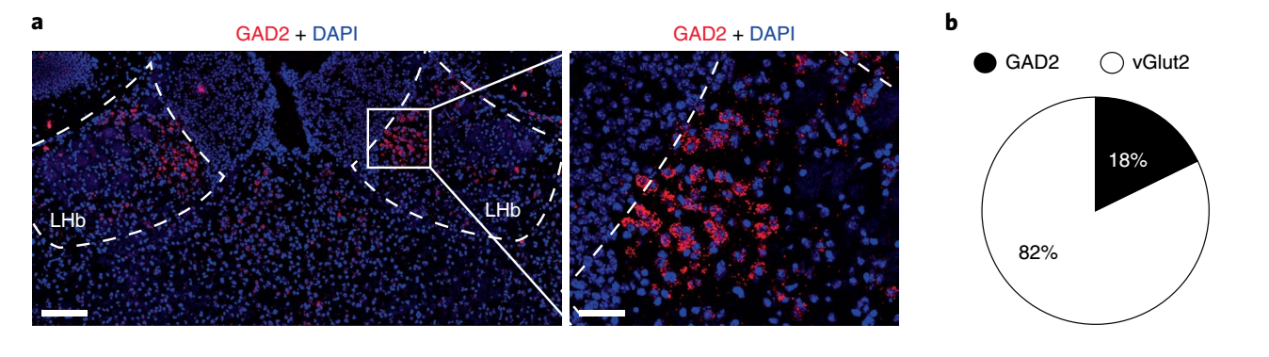
图2 僵核中抑制性和兴奋性神经元的组成
进一步通过免疫荧光实验发现LHb神经元约18%为表GAD2(谷氨酸脱羧酶2)的抑制性神经元,80%为VGlut2的兴奋性神经元。然而令人意外的是攻击性CD1小鼠在攻击过程中主要是GAD2神经元激活. 因此向GAD2-cre小鼠的LHb注射AAV-Flex-GCaMP6实现特异性观察GAD2神经元的钙离子活动,结果发现在攻击过程中GAD2神经元活动降低。
离体实验发现光刺激LHb GAD2神经元后引起vGlut2神经元出现单突触抑制电流,该电流可被GABA受体拮抗剂完全阻断 .与此同时通过化学慢性激活LHb GAD2神经元后可减少vGlut2神经元激活的数量降低。这些结果表明LHb脑区中存在局部的抑制性环路,这是首次被发现的。
离体实验发现光刺激LHb GAD2神经元后引起vGlut2神经元出现单突触抑制电流,该电流可被GABA受体拮抗剂完全阻断 .与此同时通过化学慢性激活LHb GAD2神经元后可减少vGlut2神经元激活的数量降低。这些结果表明LHb脑区中存在局部的抑制性环路,这是首次被发现的。

图3,光激活GAD2神经元后可促进攻击性行为
在LHb注射光遗传学病毒AAV-DIO-ChR2,激活 GAD2神经元后小鼠的攻击行为潜伏时间缩短,攻击性行为持续时间增加,表明攻击性行为增强. 抑制该脑区GAD2神经元,尽管并不能阻断攻击行为,但在一定程度上减弱攻击行为,具体表现为攻击行为的潜伏期延长,攻击的总时间减少。
食欲素(OxR2)神经元细胞体仅位于下丘脑外侧(LH),但是可以投射到僵核。食欲素之前尚未报道参与攻击行为,但参与药物成瘾、社交行为等多种行为。

图4 GAD2神经元高度表达OxR2
那么OxR2是否介导LHb脑区调控攻击行为呢?首先,实验证明:几乎所有的GAD2神经元表达OxR2,而不到10%的vGlut2神经元表达OxR2。其次,在连续3天的攻击行为后LHb脑区GAD2神经元表达OxR2增加。这些结果从某种程度上来说可以说明OxR2信号参与攻击行为。

图5 激活LHb脑区OxR2神经元促进攻击
研究人员进一步通过光遗传学特异性激活LHb脑区OxR2神经元后降低该脑区整体神经元活性的同时促进攻击行为。另一方面,抑制LHb脑区OxR2神经元后明显降低攻击行为。
既然GAD2神经元高表达OxR2,那么降低OxR2是否影响攻击行为。基于这种考虑,研究人员通过向GAD2-cre小鼠的LHb 脑区AAV-miR-OxR2特异性沉默GAD2神经元OxR2后小鼠的攻击行为也明显减弱。基于这些结果,表明OxR2参与调控LHb脑区介导的攻击行为。
总的来说,本文通过多个病毒载体工具发现LHb脑区激活LHb脑区OxR2神经元通过OxR2信号通路调控雄性小鼠的攻击行为。
既然GAD2神经元高表达OxR2,那么降低OxR2是否影响攻击行为。基于这种考虑,研究人员通过向GAD2-cre小鼠的LHb 脑区AAV-miR-OxR2特异性沉默GAD2神经元OxR2后小鼠的攻击行为也明显减弱。基于这些结果,表明OxR2参与调控LHb脑区介导的攻击行为。
总的来说,本文通过多个病毒载体工具发现LHb脑区激活LHb脑区OxR2神经元通过OxR2信号通路调控雄性小鼠的攻击行为。
光抑制:
| rAAV-CaMKIIa-eNpHR3.0-EYFP |
| rAAV-hSyn-eNpHR3.0-mCherry |
| rAAV-EF1α-DIO-eNpHR3.0-EYFP |
| rAAV-CAG-DIO-eNpHR3.0-mCherry |
| rAAV-hSyn-Coff Fon-eNpHR3.0-EYFP |
原文链接:https://www.nature.com/articles/s41593-020-0617-7








