武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
IF=28.7【知识窗】Nat Rev Neurosci|突触标记技术:从环路追踪到记忆解码的前沿进展
95 人阅读发布时间:2026-01-04 15:19
编者按
突触将神经元连接成细胞微环路与全脑网络。神经元通过这些细胞结构发送电信号与化学信号进行交流,以支撑特定的大脑功能与状态。基于荧光蛋白的指示剂、高分辨率成像设备等可视化工具的问世,使得神经元与突触能够被细致观察。这类工具被设计用于标记形成突触连接的神经元、突触前与突触后神经元的接触界面或突触蛋白,并已被用于观察由行为或感觉刺激诱导的神经环路结构变化。
学习与记忆领域是突触结构与功能研究的重点方向之一。这类研究聚焦于解析突触如何参与将经验转化为长期记忆存储的过程。通过检测即刻早期基因(IEGs)——如Fos或哺乳动物活动调控细胞骨架相关蛋白(Arc)——的选择性激活表达,追踪特定任务涉及的神经环路,能够帮助我们识别参与记忆形成的神经元。同时,可视化神经元微观结构(包括细微突触变化)的工具,可为揭示记忆形成与存储的潜在机制提供有力线索。该领域研究已形成普遍共识:记忆由被称为“印迹细胞”的激活神经元编码,其编码方式是这些神经元在部分突触(即“印迹突触”)处的连接发生物理变化。印迹突触通常表现出突触可塑性升高、树突棘密度增加的特征,且这些变化与记忆表达的强度相关。然而,阐明这些印迹突触的具体性质与定位仍具挑战性。
在生物体的整个生命周期中,维持突触完整性对于行为协调举足轻重;而突触病被认为与多种神经退行性疾病及精神疾病相关,包括癫痫、孤独症谱系障碍与精神分裂症。因此,通过突触标记技术研究神经环路,也可能帮助我们理解这些疾病的病理生理学机制。
在神经系统中识别并监测神经元连接的一种常用方法,是利用荧光报告分子标记突触。近年来,这类突触标记方法的研发取得了诸多进展——这往往源于突触在记忆形成中被认为具有关键作用。如,如今已能够在活体动物中识别并追踪单个突触水平的神经元功能变化。然而,我们对“影响特定突触连接的结构变化如何介导特定脑功能”的理解仍存在巨大空白。若能开发出一种独立方法,以时空特异性方式选择性标记、监测活性突触群体,将有助于解决这一问题。
小编在这里给大家推荐韩国Bong-Kiun Kaang教授等人发表在Nature Reviews Neuroscience(IF=28.7)的综述文章“Advances in the labelling and selective manipulation of synapses”。该文综述了目前可用的突触标记技术,并依据其概念基础与靶向分子对这些方法进行分类,对比它们的优势与局限性,并提出可能的改进方案以提升其效能。这些方法具有广泛的应用价值,尤其适用于研究突触功能机制与突触病。

1.基于突触连接标记神经元
通过标记突触前和/或突触后神经元来指示突触连接存在的分子探针设计,对于追踪突触具有至关重要的意义。
1)cFork顺行追踪系统
cFork顺行追踪系统采用腺相关病毒1型(AAV1)作为单突触顺行追踪载体,可标记接收特定突触前输入的突触后神经元。在该技术中,编码位点特异性重组酶(如Cre重组酶、FlpO重组酶及vCre重组酶;这类重组酶可识别特定DNA序列,并诱导双floxed反向开放阅读框(DIO)侧翼的蛋白表达)的基因通过AAV1递送至小鼠的潜在突触前神经元。同时,将含重组酶依赖性基因表达盒的转基因构建体递送至突触后神经元。该表达盒受哺乳动物基因表达启动子调控,如巨细胞病毒即刻早期启动子(CMV)或人延伸因子1α启动子(EF1a)。在这些表达盒中,不同重组酶特异性DIO序列[如Cre响应性DIO(cDIO)、FlpO响应性DIO(fDIO)及vCre响应性DIO(vDIO)]侧翼连接编码不同发射波长荧光蛋白的序列,如增强型绿色荧光蛋白(EGFP)、mScarlet红色荧光蛋白或mCerulean3青色荧光蛋白。通常使用EF1a-cDIO-EGFP与CMV-fDIO-mScarlet表达盒,构建融合载体AAV-EF1a-cDIO-EGFP-CMV-fDIO-mScarlet。AAV1介导的重组酶表达系统从突触前神经元向突触后靶细胞的顺行转运,会驱动突触后神经元中荧光蛋白的表达。
将携带特定重组酶的AAV1载体递送至不同脑区的突触前神经元,可通过输入特异性标签,标记单个突触后神经元接收的来自不同脑区的多个突触前连接。然而,该系统受限于荧光蛋白的标记准确性——在体内实验中准确率约为80%。此外,该表达系统易产生伪影,其依赖于病毒颗粒的重复注射、病毒的剂量与滴度及其转导效率,进而导致对突触连接数量的低估或高估。
2)跨神经元转录调控技术(TRACT)
TRACT技术利用配体诱导的膜内蛋白酶解激活突触伴侣的转录,从而检测果蝇的单突触神经元连接。神经元经工程改造后表达一种合成配体,该配体可与突触后伴侣神经元上的基因工程受体结合。这种结合会导致(突触后神经元中)一个调控报告基因表达的蛋白片段释放。该构建体中使用的配体为CD19mCh,其包含糖蛋白CD19的胞外域(ECD)和跨膜域(TMD),并在其胞内域(ICD)添加了荧光蛋白mCherry。人工工程化蛋白SNTG4作为受体,由多种组件构成:包括结合小鼠CD19的单链抗体ECD(ID3)、果蝇Notch蛋白的Notch调控区与TMD,以及经修饰的Gal4蛋白(酵母半乳糖响应转录激活因子)。在表达UAS-GFP报告基因[Gal4蛋白与上游激活序列(UAS)结合后,方可驱动下游GFP报告基因的表达]的果蝇中,Gal4的活性可在体内证实配体对受体的激活作用。
因此,TRACT是一种仅需编码配体、受体和报告基因的三种构建体的简单技术,理论上可应用于任何物种。启动子的选择及其能够标记果蝇、斑马鱼和小鼠特定神经元群体中突触的能力,是该技术的核心优势。然而,TRACT用于识别脑环路中神经元连接的所有拟议应用尚未完成实验验证。此外,单一报告基因构建体的使用限制了该技术标记突触内分子关联及突触间神经环路连接的能力。
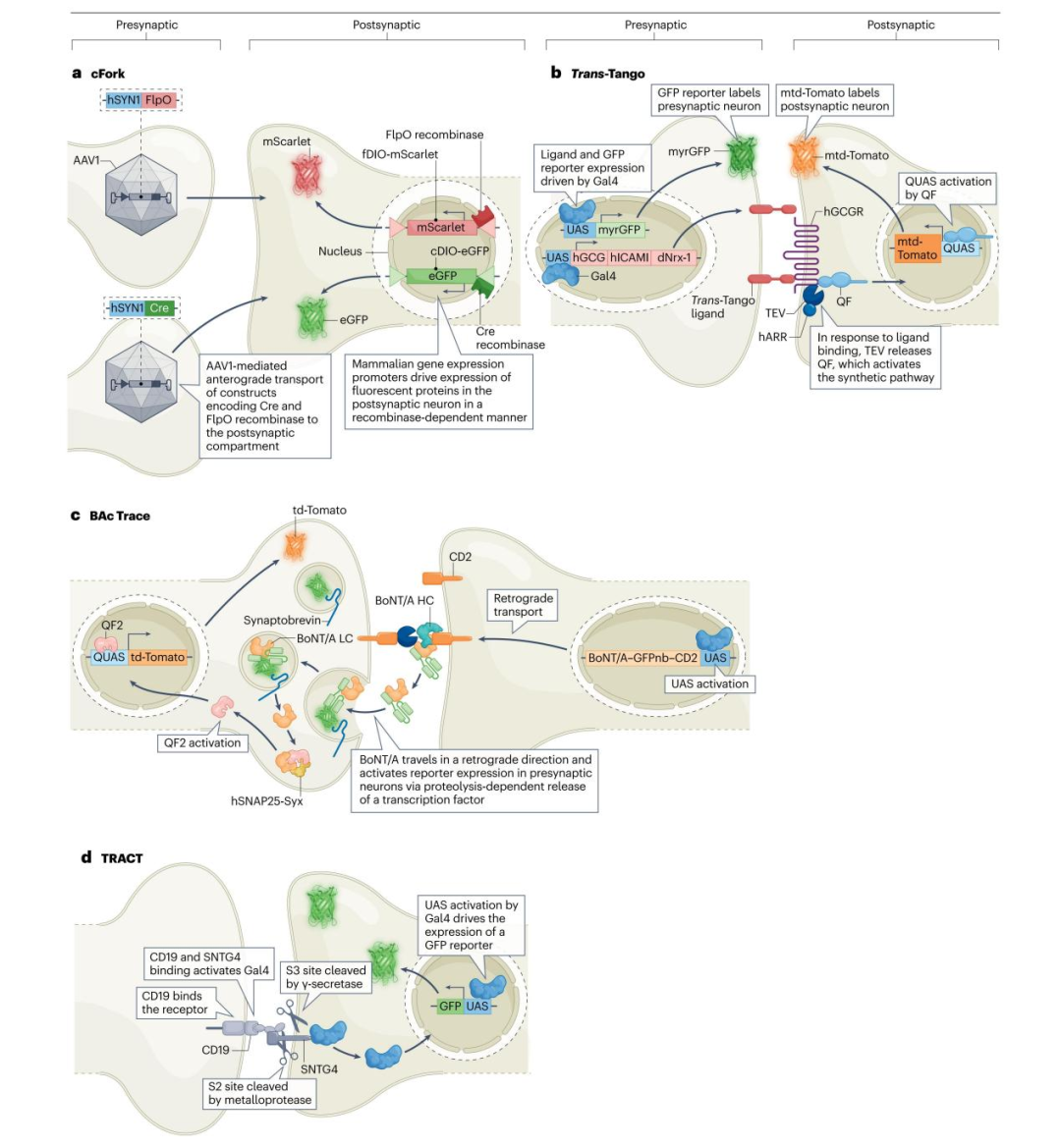
图1.形成突触连接的神经元的标记策略
2.标记突触分子
研究人员已开发出多种技术,通过荧光标记物标记突触蛋白,从而实现对相应突触结构域的可视化;或标记突触小泡,以监测突触小泡释放与神经传递过程。
1)SynLight技术及相关方法
在果蝇中,中枢与外周突触的突触前活性区可通过转基因表达编码Bruchpilot-Short的构建体进行标记——Bruchpilot-Short是活性区蛋白Bruchpilot(BRP)的截短版本,与红色荧光蛋白mStraw融合;而神经元膜则可通过转基因表达编码mCD8-GFP的构建体标记(mCD8-GFP是带GFP标记的跨膜蛋白)。因此,Bruchpilot-Short标记的斑点可通过定量分析测量突触数量,而mCD8-GFP标记的是总神经突膜。
最初,编码上述两种标记物的独立构建体需通过单一表达系统递送,这降低了表达效率。为此,研究人员开发了单一构建体SynLight,其编码的自切割肽可从同一条mRNA中生成两种蛋白。SynLight能够可视化不同神经元类型的突触活性区与细胞膜,且这些信号可被精准区分,从而实现对特定树突、轴突突起或脑区中突触数量的定量分析,同时不会干扰内源性BRP蛋白的功能与定位。
作为SynLight概念的延伸,可通过二元表达系统调控mCD8-GFP与Bruchpilot-Short-mStraw的表达,使其仅限于特定神经元群体。这有助于定量和估算特定神经元集群的总神经突膜体积,进而揭示集群的组织架构。为克服SynLight存在的转基因稀释效应(即人工导入生物体内的基因在连续繁育后代后表达量降低),研究人员验证了同时使用Gal4/UAS与QF/QUAS系统(真菌转录激活因子QF,能特异性结合其靶DNA序列QUAS,从而强力启动下游基因的转录)的多重二元表达系统。
SynLight及相关方法为研究果蝇的突触发育与组织架构提供了诸多优势。其主要局限性在于目前仅适用于果蝇模型系统。不过,未来若使用哺乳动物神经元特异性启动子,这些方法或可拓展至其他模型系统。
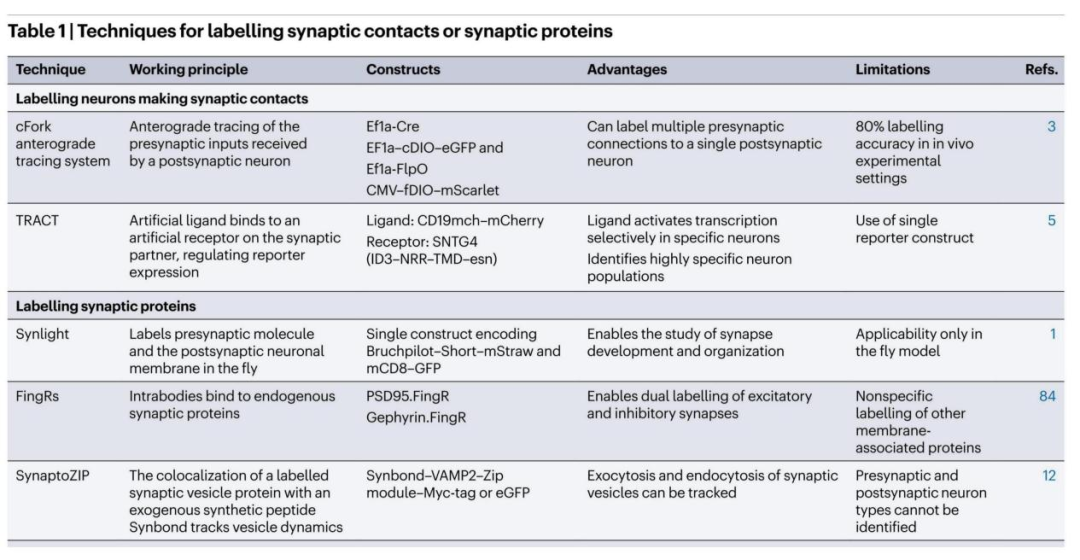
2)mRNA展示技术制备的纤连蛋白胞内抗体(FingRs)
FingRs技术利用重组抗体模拟物或胞内抗体,这类分子被设计用于结合哺乳动物模型中突触后蛋白PSD95(存在于兴奋性突触)与Gephyrin(存在于抑制性突触)。每个胞内抗体均标记有荧光标签,可实现对目标突触结构域的可视化与鉴定。重要的是,该技术中包含锌指DNA结合域的转录调控模块,会通过负反馈环路限制FingRs的表达,使其表达水平与内源性靶蛋白的等效水平相匹配。
FingRs技术的进一步改进使其能够靶向特定神经元集群,或通过选择不同荧光蛋白同时标记兴奋性与抑制性突触。借助Cre重组酶依赖型和/或逆转录病毒依赖型的FingRs表达策略,研究人员得以探究海马成年新生颗粒细胞中兴奋性与抑制性突触的变化。此外,FingRs技术还可在体内观察并定量内源性突触蛋白PSD95与Gephyrin。
FingRs方法在标记和定量突触蛋白方面具有优势;但需注意,每个标记模块仅靶向突触后结构域,且在原代培养中应用时,已发现其会对突触后致密区SAP-102和SAP-97(突触相关蛋白102和97)产生非特异性标记。
表1.突触位点或突触蛋白的标记技术
3)SynaptoZip技术
SynaptoZip技术利用荧光在哺乳动物系统中标记突触小泡。一种诱饵片段(SynaptoZip)被靶向至突触小泡。当带有SynaptoZip标签的小泡发生胞吐时,SynaptoZip可通过与外源递送的多肽Synbond结合而被标记。Synbond是一种化学合成多肽,包含Velcro卷曲螺旋异二聚体的两个组分之一,并融合有荧光标签。形成SynaptoZip构建体时,需将囊泡相关膜蛋白2(VAMP2,又称突触小泡蛋白2,一种定位于突触小泡的蛋白)的C端与Zip模块(Velcro卷曲螺旋异三聚体的另一组分)融合,随后连接Myc标签;之后将荧光蛋白EGFP融合至SynaptoZip位于胞质的N端。SynaptoZip表达后会被靶向至突触小泡,通过检测带有EGFP标签的小泡与Synbond的共定位情况,可追踪突触小泡的胞吐与胞吞过程。胞吐发生时,带有SynaptoZip标签的小泡腔暴露于突触膜,使Synbond能够与Zip模块结合;而胞吞发生时,Synbond则被内化进入小泡。该方法可用于追踪突触中小泡的循环次数,进而评估大脑最深层神经元的突触活性,还能在体内揭示皮层神经环路的活动。
然而,该技术仅能追踪发生小泡释放与循环的兴奋性或抑制性突触前神经元。将此方法与后面论述的Dual-eGRASP技术及LCD-eGRASP技术相结合,可标记脑区间与脑区内的突触连接,从而克服这一技术局限。
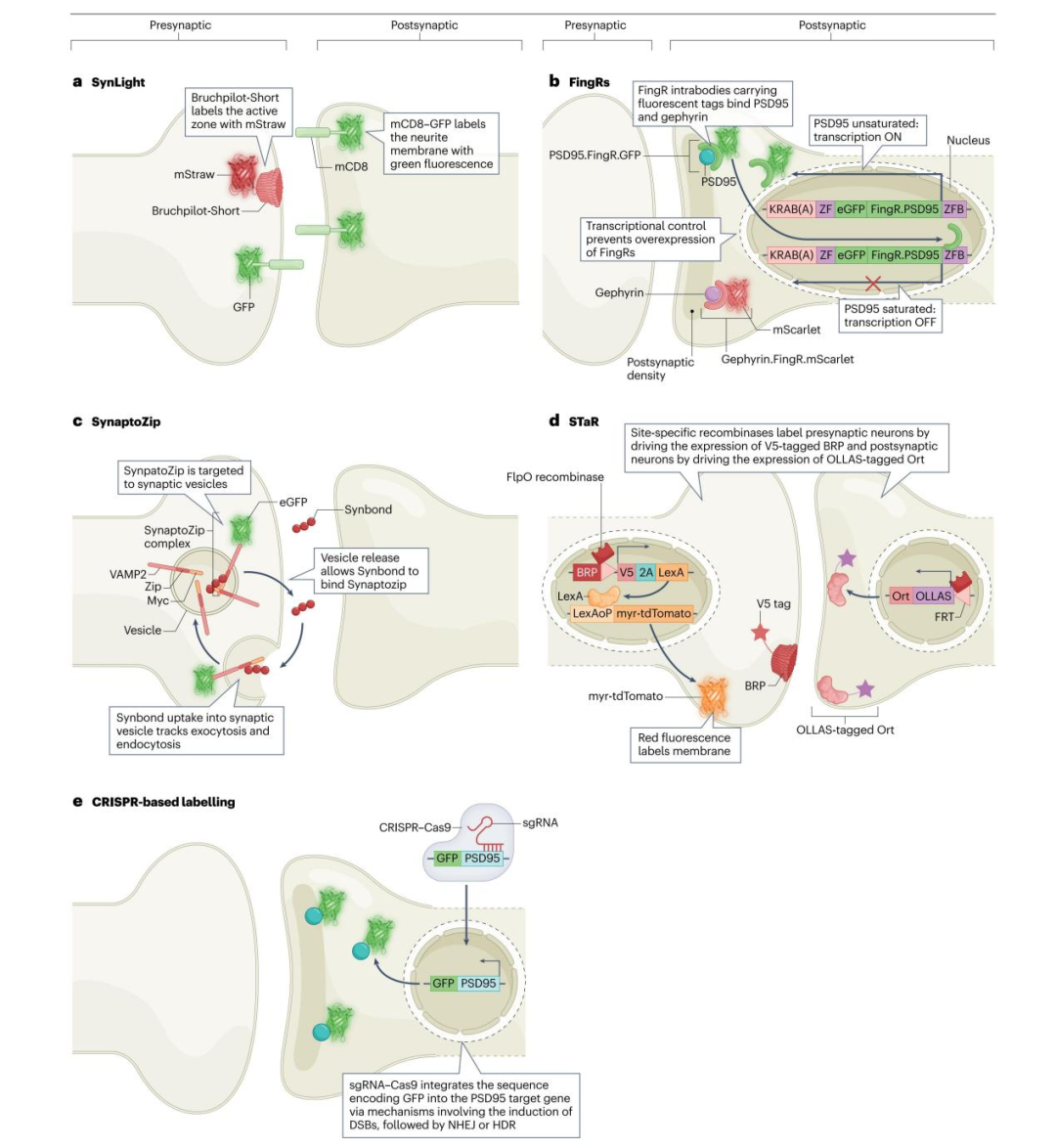
图2.突触蛋白的标记策略
3.标记突触界面
若干突触标记技术以在突触前与突触后神经元界面发生相互作用的分子对为靶向。在这些分子中,神经连接蛋白(Neurexin,NRXN)与神经配蛋白(Neuroligin,NLGN)是此类工具设计中最常用的靶向分子。
1)跨突触伴侣的绿色荧光蛋白重组技术(GRASP)
GRASP技术可在多物种体内实现突触连接的可视化。该技术灵感来源于用于观察细胞内蛋白-蛋白相互作用的拆分GFP(split-GFP)方法:将GFP拆分为两个互补片段,分别与突触前和突触后跨膜蛋白的ECDs融合。split-GFP片段单独存在时无荧光活性,但当二者距离足够近时会重组为完整的功能性GFP。其中较大的片段包含GFP的前214个氨基酸残基,构成其β-桶状结构的10条β-折叠链(GFP 1-10);较小的互补片段包含GFP的215-230位残基,构成其β-桶状结构的第11条β-折叠链(GFP 11)。在最初的GRASP研究中,split-GFP片段与神经配蛋白1(NLGN1)融合——在秀丽隐杆线虫中,NLGN1既可作为突触前黏附分子,也可作为其突触后伴侣发挥作用。
GRASP技术的一个优势是:它能特异性检测已存在的突触连接,不会诱导新的突触形成(尽管GRASP组件的长期表达可能产生此类伪影)。该技术最初仅适用于秀丽隐杆线虫,目前已开发出适用于哺乳动物大脑的同类方法。但需注意的是,最初的GRASP技术仅能通过一种颜色标记所有神经元。
2)哺乳动物GRASP技术(mGRASP)
mGRASP技术是GRASP技术的升级版,已被用于标记小鼠、线虫和果蝇的突触。该技术中,研究人员筛选出跨膜split-GFP构建体以实现对哺乳动物突触的标记。首先,对NRXN和NLGN进行重新设计,使其能够用于小鼠的突触标记;随后,split-GFP构建体被进一步优化,以避免NRXN和NLGN的过表达——这种过表达可能会促进突触成熟,并影响哺乳动物神经元的生理机制。mGRASP的每个组件均包含N端信号肽、split-GFP片段、ECD、TMD和ICD:突触前mGRASP(pre-mGRASP)组件由线虫β整合素(PAT-3)的1-29位残基、GFP 11的215-230位残基、两段串联的柔性甘氨酸(Gly)-Gly-Gly-Gly-丝氨酸(Ser)(GGGGS)连接子、人CD4-2的ECD(25-242位残基)、大鼠神经连接蛋白-1β(NRXN1)C端的ICD(414-468位残基)以及单体青蓝色荧光蛋白(mCerulean)构成;突触后mGRASP(post-mGRASP)则包含酯酶截短的NLGN1信号肽(1-49位残基)、GFP 1-10、71个残基的ECD、19个残基的预测TMD、小鼠NLGN1的C端、自剪切2A肽以及红色荧光蛋白dTomato的胞质端。对post-mGRASP中NLGN1组件的修饰,可避免其与内源性NRXN发生非特异性相互作用。利用Cre重组酶依赖性的关闭(pre-mGRASP)和开启(post-mGRASP)策略,mGRASP方法可用于绘制局部突触前-突触后连接图谱,并识别空间上邻近的细胞群;通过在相隔较远的不同脑区分别表达pre-mGRASP和post-mGRASP组件,mGRASP还可成功绘制长距离神经环路图谱。
GRASP技术的另一种变体以拆分辣根过氧化物酶(split HRP)替代split-GFP作为报告分子,由于HRP可实现酶促信号放大,其标记突触的亮度高于重组GFP。但尽管该方法具有高灵敏度和特异性,外源标记试剂与辅因子的递送步骤仍需优化,才能实现体内突触的可视化。
利用mGRASP或split HRP技术,可检测NRXN与NLGN之间的蛋白-蛋白相互作用,但该技术存在以下局限:无法区分突触群体中的活性突触与非活性突触——这是理解任务依赖性特异性记忆形成机制的关键问题;标记仅限于单一颜色,无法用于可视化区分不同神经环路;此外,若缺乏标记兴奋性或抑制性神经元的神经元特异性启动子,便无法识别神经元类型特异性的突触连接。
表2.突触界面的标记方法
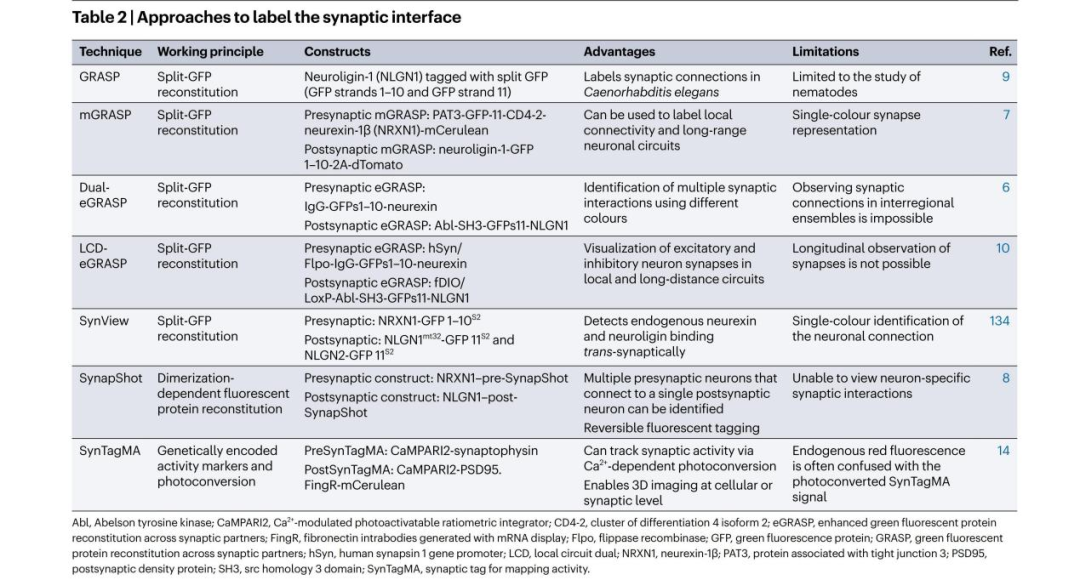
3)增强型GRASP技术(Dual-eGRASP)
Dual-eGRASP技术借助多色荧光对突触进行标记。与其他GRASP技术相同,Dual-eGRASP采用split-GFP的设计原理。突触前eGRASP构建体包含IgG κ信号肽(可促使eGRASP蛋白从神经元膜表面释放)、GFP 1-10、p30、p32及p40肽段(能与突触后eGRASP中的Abl-SH3结构域结合),以及NRXN1的跨膜锚定区与ICD。突触后eGRASP构建体则由κ信号肽、Abl-SH3结构域、GFP 11,以及NLGN1的TMD和ICD组成。与mGRASP技术相比,Dual-eGRASP中加入p30、p32肽段及结合结构域(Abl-SH3),可提高突触间隙中GFP的重组效率。研究人员通过删除NLGN1组件最后四个氨基酸(含PDZ结构域结合位点)对其进行突变,以避免与其他受体发生非特异性相互作用。
Dual-eGRASP的独特之处在于,它能利用不同颜色标记来自不同脑区的突触输入(区别于其他GRASP技术),这一功能通过在突触前eGRASP构建体的GFP β-桶状结构1-10链中引入突变实现。Dual-eGRASP突触标记技术可揭示任务特异性记忆形成过程中发生的突触结构变化(如树突棘数量的改变)。此外,通过组合使用活动依赖型与非活动依赖型启动子驱动eGRASP构建体表达,该技术能以瞬时或组成型方式标记不同的突触群体。如,研究人员利用Dual-eGRASP区分出四种突触连接类型:印迹突触-印迹突触(E-E)、印迹突触-非印迹突触(E-N)、非印迹突触-印迹突触(N-E)和非印迹突触-非印迹突触(N-N)。已有研究证实该技术可在小鼠体内实现上述应用。通过优化启动子系统,还能标记印迹神经元的下游神经元。
值得注意的是,由于该技术未采用可区分兴奋性与抑制性神经元的启动子,无法辨别这两类神经元形成的突触连接;但将其与特定神经元类型中表达重组酶的转基因小鼠品系联用,即可解决这一问题。最后,NRXN和NLGN的长期过表达可能产生人工干扰信号,这是GRASP技术的普遍局限性。因此,优化递送eGRASP构建体的病毒滴度及表达时间节点,对成功标记神经环路至关重要。
4)LCD-eGRASP技术
LCD-eGRASP是Dual-eGRASP的进阶形式,能够区分神经元集群内两种不同神经元类型(兴奋性与抑制性神经元)之间形成的突触,从而突破了Dual-eGRASP最显著的局限性。LCD-eGRASP采用的构建体策略与Dual-eGRASP相似,但对部分启动子进行了修饰,以实现对抑制性神经元突触的特异性标记。研究人员通过在突触前eGRASP构建体中引入cDIO元件标记表达Cre重组酶的γ-氨基丁.酸能(GABAergic)神经元;对于兴奋性神经元标记,则利用人突触素1基因启动子(hSyn)及钙/钙调蛋白依赖性蛋白激酶Ⅱα(CaMKIIα)启动子驱动的fDIO元件调控突触后eGRASP构建体的表达。同理,可通过调整启动子系统标记兴奋性神经元与抑制性神经元之间的突触。
鉴于有证据表明CaMKII启动子在抑制性神经元中存在非特异性激活,研究人员在突触后eGRASP构建体中添加了依赖于Cre重组酶切除的loxP序列(LSL),以最大限度减少CaMKII启动子驱动的蛋白在抑制性神经元中的表达。该技术适用于兴奋性与抑制性神经元的区域内突触标记,但尚未被验证可用于突触的长期观察。
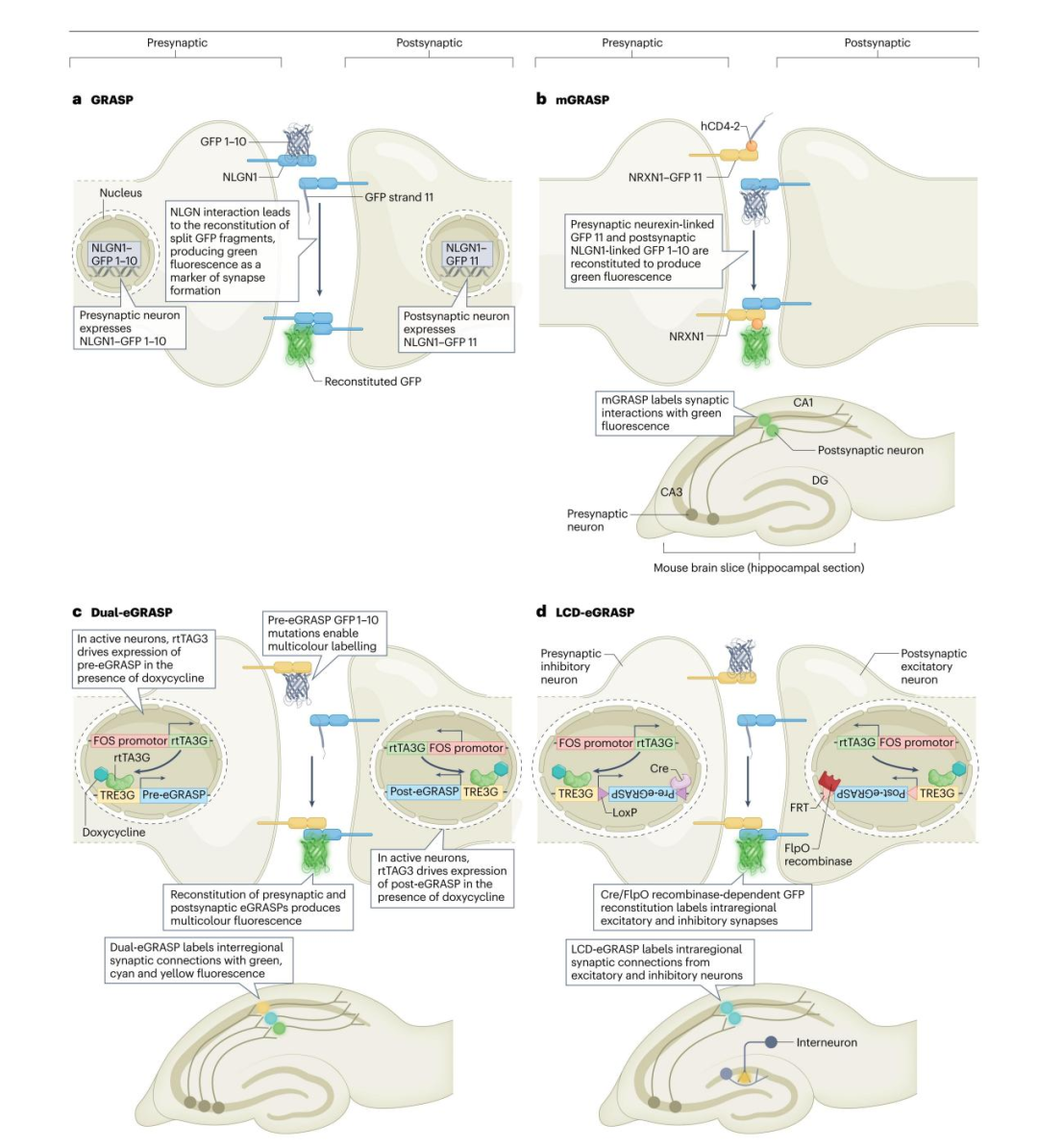
图3.基于GRASP技术的突触连接标记方法
5)SynView技术
SynView是一种遵循GRASP原理、以NRXN和NLGN为靶点的突触标记方法。研究人员构建了融合split-GFP片段的NRXN1、NLGN1及NLGN2蛋白,并针对哺乳动物系统优化了其表达策略。突触前构建体包含融合GFP 1-10的NRXN1,突触后构建体则包含融合GFP 11的NLGN1或NLGN2。NRXN1与NLGN的跨突触结合已在原代培养模型中得到验证——该模型中海马神经元可与非神经元COS-7细胞形成突触。由于构建体中保留了NRXN1和NLGN1的胞外配体结合域,因此GFP片段仅在NRXN1与NLGN发生跨突触结合时才能完成重组。这一特性使SynView区别于mGRASP技术:mGRASP中GFP重组仅需两个split-GFP片段相互结合即可实现。但该方法无法通过多色标记识别来自不同脑区的神经元连接,而利用神经元特异性启动子与多种报告基因或可拓展其应用范围。需注意的是,所有基于split-GFP的技术均存在一个共性局限:由于重组GFP的成熟速度缓慢,且split片段的结合具有不可逆性,这类技术无法实时捕捉突触强度的变化。
6)突触活动定位标记技术(SynTagMA)
SynTagMA技术能够识别并监测活性突触。该方法通过构建基因编码报告分子实现:当此类报告分子与钙离子结合时,经395-405 nm波长光照射,其荧光会从绿色转变为红色。研究人员将钙离子调控的光激活比率整合蛋白CaMPARI2与突触前蛋白突触素(Synaptophysin)融合(构建preSynTagMA),以靶向突触前神经元;或与FingR.PSD95偶联(构建postSynTagMA),以靶向突触后神经元。与多数仅能表征突触解剖特征或突触前、后膜邻近关系的标记方法不同,SynTagMA可实现对活性突触的识别与追踪。因此,通过检测报告分子转化与未转化的比例,preSynTagMA可用于区分特定时间窗口内的活性突触与沉默突触;而postSynTagMA则可标记活性突触后结构域。postSynTagMA蛋白在细胞核中的组分,能够识别特定任务中被激活的突触后神经元。
SynTagMA最突出的优势在于,它可广泛应用于较大组织体积内突触的细胞或突触水平三维(3D)成像。该技术的局限性包括:成像前或成像过程中,需利用紫光将蛋白光转换至亮态,而紫光对活体样本而言是不利的波长;由于突触位点存在分子扩散与交换,成像需在光转换后短时间内完成(约30分钟内);此外,需通过严谨分析区分红色自发荧光(通常为基线红色荧光强度的0.4%-4%)与光转换后SynTagMA产生的信号。
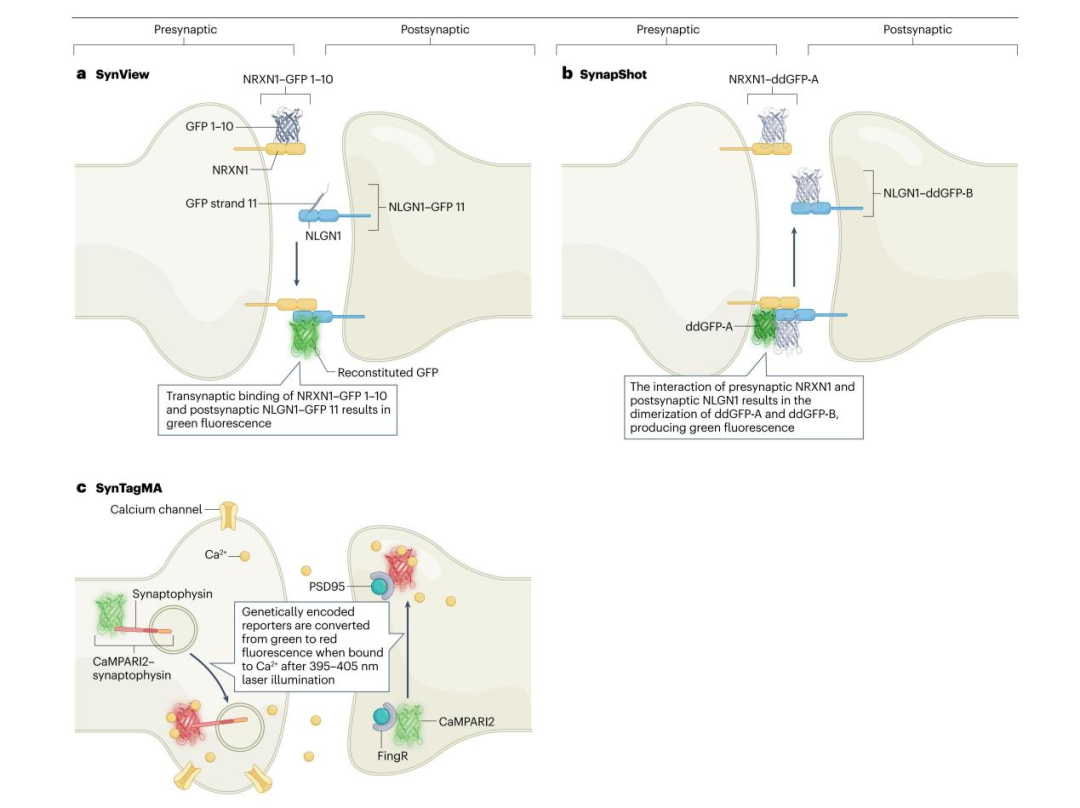
图4.突触前膜与突触后膜结构域相互作用的其他标记技术
4.突触标记技术的挑战
已开发的突触标记技术具有创新性,但以选择性方式标记特定神经元群体及突触仍面临挑战。尽管借助现有技术,我们已获取关于记忆形成相关复杂分子机制的部分信息,但其他研究领域也面临类似问题。
迄今为止,多数记忆形成相关研究聚焦于突触连接的标记,但许多所用技术的适用性仅限于特定生物:如,Synlight和TRACT均仅适用于果蝇模型,其在哺乳动物系统中的广泛适用性尚未得到探索。另有部分技术(如cFork)准确性有限,且会产生非特异性伪影。因此,需对这些现有工具进行改良,以确保其适用于哺乳动物的突触标记。
多数靶向突触间隙中突触前-突触后相互作用的技术,均借助GFP重组介导的荧光进行突触标记。但这些技术需表达一种或多种荧光报告分子,而这些蛋白的表达及降解时间窗口限制了当前的突触标记效果。为克服这些挑战,我们需开发新策略以调控荧光蛋白的表达持续时间及降解速率。在这类工具中,SynView缺乏多色识别能力,限制了其通用性。SynTagMA需依赖紫光进行光转换,使其在活体样本中的应用受限;此外,内源性红色荧光分析易出现解读偏差。因此,这些技术仍需进一步优化,以突破现有局限,最大限度发挥其在突触功能及可塑性研究中的潜力。
总体而言,突触标记技术需在特异性、灵敏度及时空分辨率之间实现必要平衡,这仍是一项挑战;同时,在标记目标突触的同时避免干扰邻近结构,以及实现精准的细胞类型特异性标记,也一直是亟待解决的问题。开发能够突破所有这些局限的理想工具,对于破解记忆编码、储存与提取的奥秘不可或缺。
展望
仅针对神经元突触前膜或突触后膜结构域进行标记的技术,仅能呈现突触传递过程中单一环节的有限视角,从而限制了其对复杂神经环路的标记能力。我们需要开发能够利用特异性突触前膜标志物,标记单个突触后神经元所对应的多个突触前连接的病毒载体。此类技术改良将为突触研究提供更有力的工具支持。
突触标记技术的应用场景并非局限于学习记忆研究。该类技术可拓展至神经发育变化的观察,为解析神经环路的建立与精细化调控机制提供线索;亦可用于绘制神经退行性疾病中常受损的神经网络及突触连接图谱,为开发潜在治疗干预措施提供理论依据。
我司可提供FingRs、mGRASP、eGRASP相关病毒产品,列表如下:

如有相关需求,或了解更多产品服务,欢迎咨询我们!点击进入店铺,查看更多产品及服务