武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【文献解读】慢病毒助力,改造巨噬细胞,抗肿瘤新策略
888 人阅读发布时间:2024-08-13 08:57
胃肠道肿瘤,如结直肠癌(CRC)和胰腺导管腺癌-瘤(PDAC)的肝转移的存在是癌症患者预后的一个负面因素。尽管在药物治疗方面取得了进展,比如免疫治疗和肿瘤靶向方法,最有效的治疗选择仍然是手术切除,这适用于有限数量的患者。肝转移的高发生率部分归因于从消化系统流向肝脏的血流以及肝窦的结构和功能特征,这些因素共同有利于转移性定殖,以及肝脏的耐受性微环境,这抑制了保护性免疫反应。
通过对肝巨噬细胞(包括库普弗细胞(KCs)和肿瘤相关巨噬细胞(TAM)的基因工程来加强肝脏中细胞因子的表达,可能提供一种有效的策略来重新编程肝脏TME,使其进入免疫反应状态,从而促进保护性抗肿瘤免疫反应的干扰素a (IFNa)是一种以其抗病毒和多效性免疫活性而闻名的细胞因子,可能是一个潜在的候选者,通过同时增强免疫细胞的抗肿瘤功能来重编程肝脏TME,同时靶向新血管生成的内皮细胞和癌细胞然而,其作为全身给药的临床应用一直受到严重的非肿瘤副作用和不利的药效学和药代动力学的阻碍。
今天推荐的是一篇肿瘤免疫的文献:In vivo macrophage engineering reshapes the tumor microenvironment leading to eradication of liver metastases。作者借助慢病毒改造巨噬细胞,通过实现先天和适应性免疫激活,快速促进对CRC和PDAC肝转移的不同小鼠模型的治疗反应。慢病毒凭借自身基因组可以整合入,宿主细胞的基因组中的特点,成为标记体内巨噬细胞的首要选择。
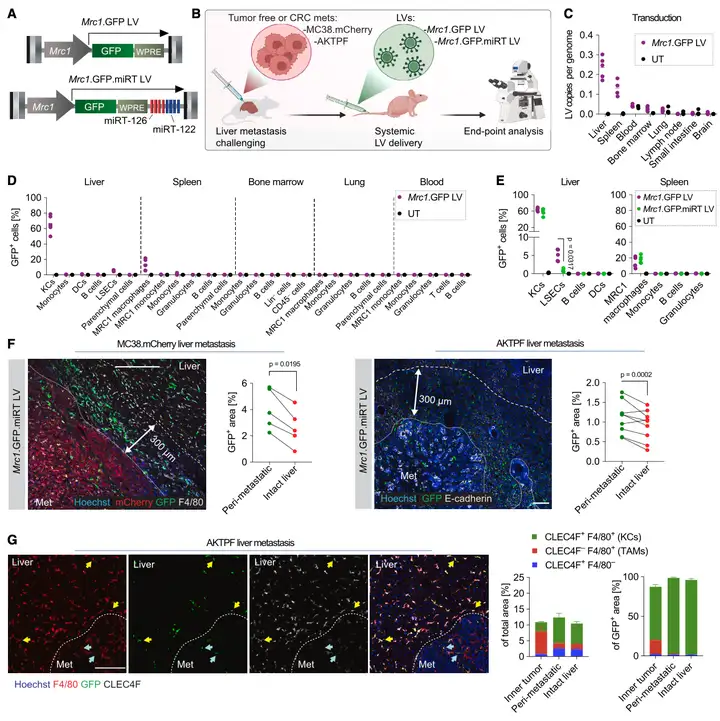
Result 1: 构建慢病毒载体,在体感染巨噬细胞
为了在体内标记巨噬细胞,作者选择慢病毒,Mrc1启动子(Figure 1A)。感染效果显示:LV-Mrc1-GFP在IL-4暴露的(M2样)骨髓源性巨噬细胞(BMDM)中驱动了强大的转基因表达,但在LPS/IFNγ暴露的(M1样)BMDM中不驱动。向免疫功能受损的小鼠静脉注射LV-Mrc1-GFP导致GFP在肝细胞(KCs和肝窦内皮细胞,LSEC)和一些脾细胞(Mrc1阳性巨噬细胞)中选择性表达(Figure 1B-D)。为了降低肝泄漏,作者改造了载体,加入了miR122TS,LV-Mrc1-miR122TS-GFP(Figure 1E)。总之,作者改造的新载体LV-Mrc1-miR122TS-GFP,可在肝巨噬细胞中选择性表达,并富集在肿瘤区域,具备了向肝肿瘤区域递送治疗分子的可行性。
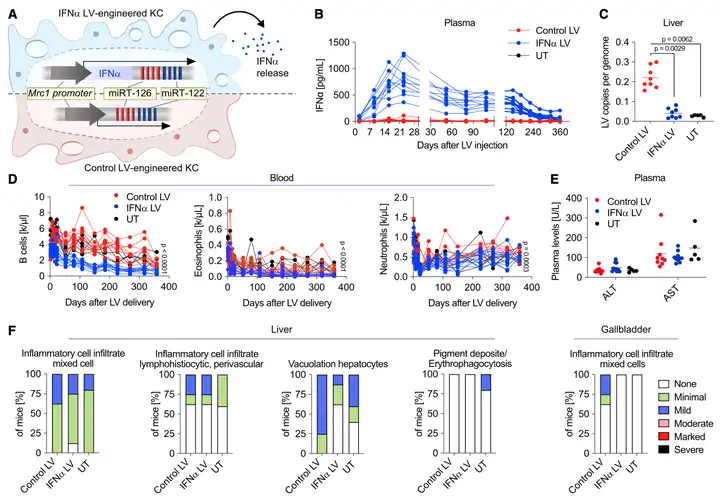
Result 2: 慢病毒在体内,操控巨噬细胞产生IFNα
作者将改造好的LV-Mrc1-IFNα-miR122TS-GFP,尾静脉注射小鼠,在肝免疫细胞内释放IFNα(Figure 2A)。三周后,检测血浆中IFNα的浓度达到峰值700-1000pg/ml,此后浓度稳定在200+(Figure 2B)。作者还观察了其他免疫细胞,像单核细胞、红细胞、血红单白水平(Figure 2C-E),结果显示:慢病毒可以介导肝巨噬细胞,稳定的释放IFNα,而且慢病毒在小鼠体内的耐受性良好。
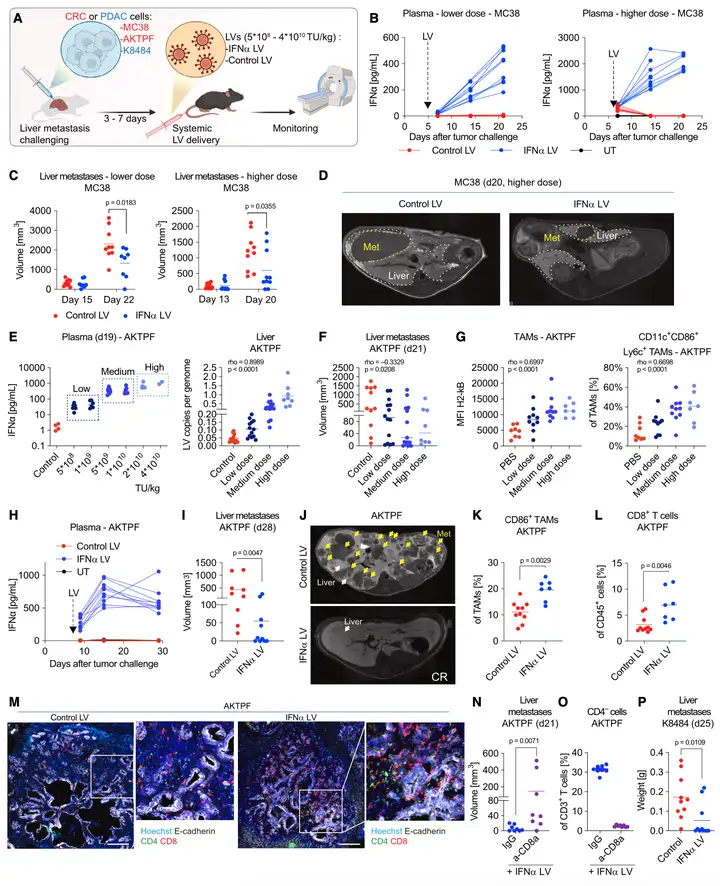
Result 3: 慢病毒过表达IFNα,促进T细胞活化,抑制肝癌细胞转移
作者测试了慢病毒对IFNα的浓度,是否存在剂量依赖性,作者摸索最佳给药剂量后(Figure 3A-D)。借助AKTPF-CRC细胞,检测免疫激活的程度,结果显示治疗组的炎性标记物增加(Figure 3E-G);且慢病毒操控肝巨噬细胞释放的IFNα,可以在体外肝肿瘤模型中,显著抑制肿瘤生长(Figure 3P)。
Result 4: LV-IFNα在肝肿瘤内的转染,具有区域优先性。
作者使用空间转录组学来研究转移性肝脏中是否存在IFNα优先信号传导区域,通过比较对照组、应答组与抗性组。结果显示:在所有队列中,与肝转移之外的区域(转移周围和完整的肝脏)相比,属于与癌症相关的生物学过程或途径的基因在转移区域(内部和前部区域)富集。上皮细胞相关基因如Epcam、钙粘蛋白1(Cdh1)和绒毛蛋白1(Vil1)在内部和前部转移区域高度表达。相反,肝细胞相关基因以及属于肝脏相关途径的基因集在完整的肝脏区域上调(图4B)。值得注意的是,与T细胞耗竭和耐受表型相关的标志物,如Tgfb1、Eomes和Gzmk,在耐药组的内部、前部和转移周围区域也上调(图4B和4C)。总之,肝巨噬细胞表达IFNα与应答小鼠肝转移和转移周围区域的选择性免疫激活有关。然而,在耐药小鼠中,与应答者相比,免疫激活似乎受到抑制,并且与转移/肝实质边界区域IL-10信号的富集有关。
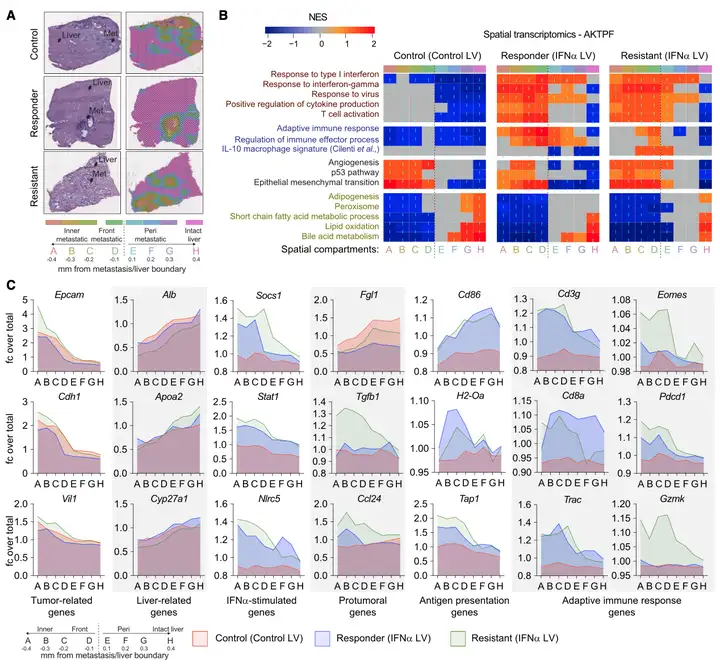
Result 5: 耐药性与Eomes CD4+T细胞浸润有关。
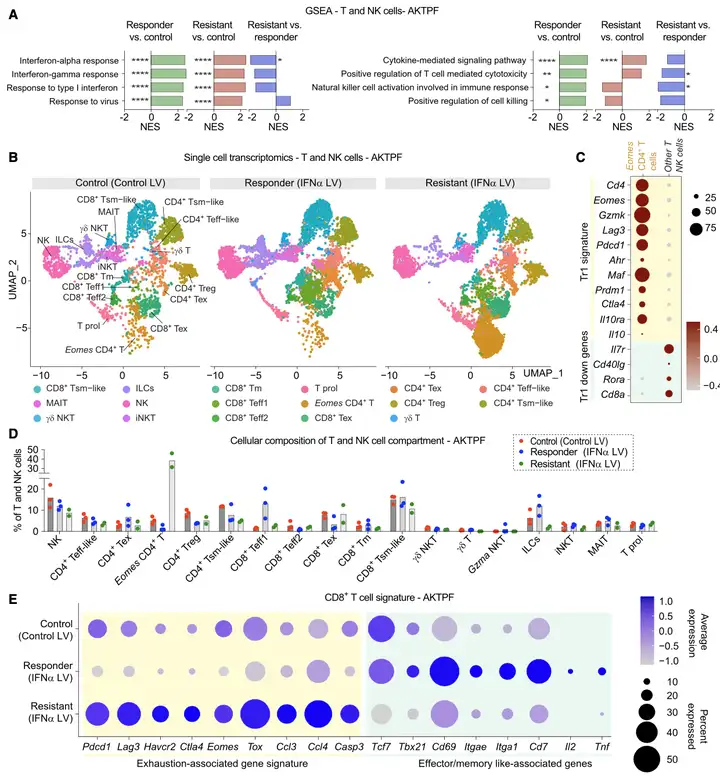
作者对三组实验进行了T细胞和NK细胞的差异化表达分析。结果显示:LV-IFNα通过重塑T细胞浸润来促进应答小鼠的适应性免疫,富集与免疫疗法应答相关的效应表型,同时抑制T细胞耗竭。相反,在耐药小鼠中,浸润Eomes CD4+T细胞和增强CD8+T细胞的耗竭可能会阻止抗肿瘤作用。
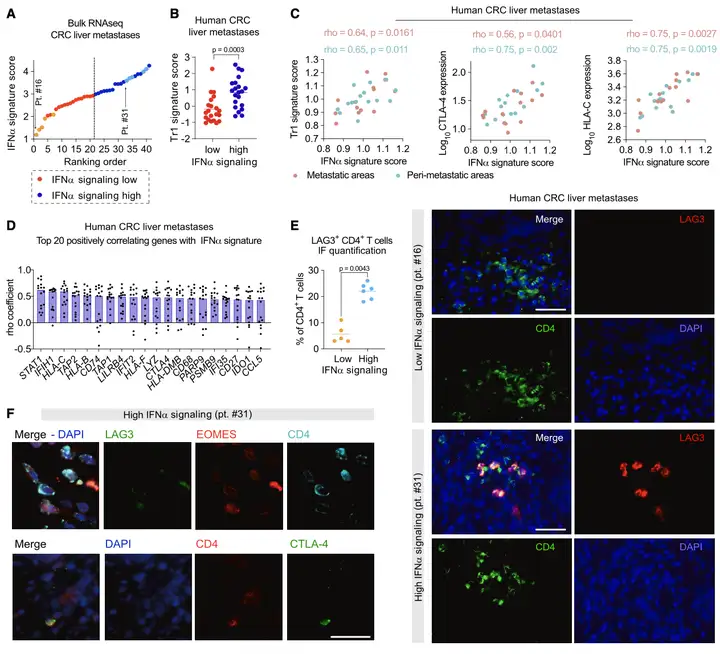
Result 6: 人肝癌中,IFNα与Tr1的基因呈正相关。
作者搜集了人类肝癌中RNA测序数据,结果显示:IFNα信号评分较高的患者显示出较高水平的Tr1特征评分(Figure 6A-B),CTLA4表达和HLA-C表达之间呈正相关(Figure 6 C)。作者对11名肝肿瘤患者进行免疫染色,IFNα高分组中LAG3+CD4+T细胞浸润患者转移灶的百分比更高(Figure 7E),结果证明:Tr1样细胞以及CTLA-4的表达与内源性IFNα信号传导呈正相关。
Result 7: 来自工程化肝巨噬细胞的IFNa与调节性T细胞的功能抑制结合可根除肝转移
为了探索更好的肝肿瘤治疗方案,作者尝试LV-IFNα与CTLA-4单抗联合治疗,结果显示:通过抑制调节性Eomes CD4+T细胞、耗尽的CD4/CD8+T细胞和CD4+Treg细胞中的CTLA-4来增强APC中的抗原呈递,强烈增强了IFNα LV的治疗活性,揭示了CTLA-4对治疗耐药性发展的关键作用。
小结
作者开发新的慢病毒载体LV-Mrc1-IFNα-miR122TS-GFP,测试了有效性和安全性后,证明新载体和通过先天免疫和适应性免疫,对两种肝癌模型(CRC和PDAC),起到免疫激活和肿瘤抑制的作用。最后,新载体搭配CTLA-4单抗联合治疗,绕开免疫逃逸机制,为临床实验提供了理论基础。
| 过表达 | LV-Mrc1-IFNα-miR122TS-GFP |
| 过表达 | LV-Mrc1-IFNα-GFP |
| 对照 | LV-Mrc1-GFP |
参考文献
Kerzel T, Giacca G, Beretta S, Bresesti C, Notaro M, Scotti GM, Balestrieri C, Canu T, Redegalli M, Pedica F, Genua M, Ostuni R, Kajaste-Rudnitski A, Oshima M, Tonon G, Merelli I, Aldrighetti L, Dellabona P, Coltella N, Doglioni C, Rancoita PMV, Sanvito F, Naldini L, Squadrito ML. In vivo macrophage engineering reshapes the tumor microenvironment leading to eradication of liver metastases. Cancer Cell. 2023 Nov 13;41(11):1892-1910.e10. doi: 10.1016/j.ccell.2023.09.014. Epub 2023 Oct 19. PMID: 37863068.
如有相关需求,或了解更多产品服务,欢迎咨询我们!
点击进入店铺,查看更多产品及服务