武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
神经细胞稀疏标记方法有哪些?稀疏标记病毒该如何选择?
4684 人阅读发布时间:2023-09-18 09:10
神经细胞稀疏标记是研究解剖结构,神经元形态功能表征,谱系追踪,对基底神经节、海马、新皮层、丘脑、嗅觉皮层等区域及神经调制系统中单个轴突投射在长程范围内的路径绘制以及环路重构的重要技术。目前,对特定区域特定类群神经元稀疏标记,可通过转基因动物、子宫内质粒电穿孔以及示踪病毒标记等方法来实现。标记方法的发展结合新的电子显微技术、超高分辨率光学显微技术和宽场照明成像技术等,实现了从特定细胞集群形态功能表征,活动记录操控到精细结构成像的整合。传统的稀疏标记方法(Golgi染色)中接近1%的神经元被标记,除标记数量外,兼容光学成像的稀疏标记还要求被标记的神经元形态足够精细,胞体、轴突、树突和树突棘等亚结构足够高亮,将来自不同胞体并行或串行的轴突区分开以避开光学成像系统的分辨极限,从而研究形态功能,解析单个神经元的投射组及重构神经环路。
1.1 Thy1-XFP小鼠
Thy1-XFP的转基因小鼠是广泛应用于大脑神经系统成像分析的工具鼠。Thy-1(immunoglobulin superfamily of proteins成员,又称CD-90),是在神经细胞和小鼠T淋巴细胞高丰度表达的糖蛋白。在Thy1-XFP小鼠的构建过程中,thy1基因的调控元件经过改造(内含子序列的选择性删除),使其仅在一定比例的,如10%左右的神经元中有荧光蛋白的表达。在部分Thy1品系中,观察到脑膜、血管周、脉络从、淋巴结和脑组织中单核细胞来源的细胞亦有标记。thy1基因在出生后小鼠的早期发育阶段的神经元中表达水平显著上升,报告蛋白的亮度也逐渐增加,且在不同品系之间,报告蛋白的表达模式存在着脑区之间以及不同细胞类群的差异。个别品系小鼠,在其胚胎发育期(E13. etc)即可观察到报告蛋白在运动神经元轴突的高表达,可用来分析活体胚胎初始阶段的突触生成。除Thy1,通过沉默特异启动子的策略还可构建其他转基因品系用于标记特定类群的神经元,如Drd1a-bacMORF小鼠,标记了纹状体中1%的表达D1(多巴胺受体)的中等多棘神经元。
动物模型是构建小鼠脑神经环路及绘制连接图谱的有力工具。借助于此,面向小鼠的全脑光学显微成像技术,如显微光学切片断层成像(Micro-Optical Sectioning Tomography, MOST)系列技术,突破光学成像深度限制,获取到厘米见方的环路结构信息,展示了小鼠全脑内长距离轴突投射通路的连续追踪。将此类动物用于神经元投射成像,需要考虑以下几个方面:1)报告蛋白能够完整标记末端结构(突触前,突触后完全重合);2)对肌纤维和非神经元细胞的标记应尽可能少,而且大多数运动神经元会被标记;3)报告蛋白在轴突的扩散或者运输至少长达几厘米,肌肉中长距离轴突被标记;4)外周近端和远端神经的标记强度不应该有过于明显的差异;5)报告蛋白在活组织及PFA固定后的组织样本中应保留荧光强度。
1.2 dCre小鼠
利用Cre转基因小鼠一定程度上避免了使用电穿孔和病毒注射的基因投递策略,并在特定类型细胞实现诱导型强表达报告基因及记录神经元活动相关的不同版本的遗传编码电压/钙指示剂 (GEVIs /GECIs)。其中一种Cre突变体dCre (destabilized Cre)活性由TMP(antibiotic trimethoprim )控制,而TMP在哺乳动物中不存在天然靶点且能够穿过血脑屏障。腹腔注射后10 min在小鼠脑内达到峰值,30 min后降至检测下限,dCre的瞬时稳定并引发位点特异的重组。基于这种快速响应,采用特异性启动子驱动dCre表达,指示剂可以实现类似高尔基染色的图式。
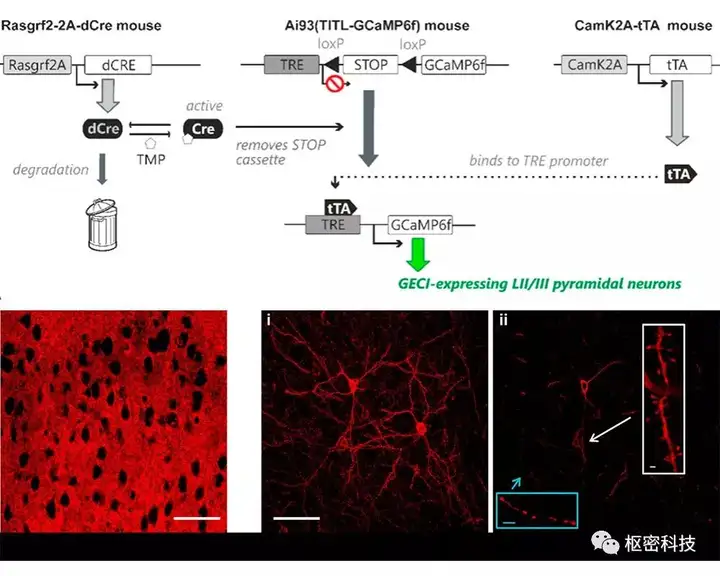
图 1. Rasgf2-2A- dCre小鼠稀疏标记的遗传策略 (Top);结合低剂量的TMP处理用于皮层layerII/III锥体神经元精细结构标记 (VSFP butterfly指示,Bottom) [Ref 5] 。
使用子宫内电穿孔法(IUE, in utero electroporation)导入外源基因瞬时表达,对导入的外源基因片段的大小没有限制,可同时表达多个基因,载体的形式灵活。在新皮层、海马、杏仁核、纹状体、中脑、背侧丘脑、下丘脑、小脑、视网膜和脊髓等多个脑区都有应用,是一种比较好的标记方法。
2.1. 基于特异启动子的PASME标记
PASME标记(promoter-assisted sparse-neuron multiple-gene labeling using in utero electroporation),结合了特异启动子Thy1S,Cre-loxP系统和IUE基因转移方法,在单细胞水平操控特定类型细胞,展示神经元的精细结构。此处的Thy1启动子Thy1S在皮层神经元工作,实现目标脑区的神经元被稀疏高亮标记。
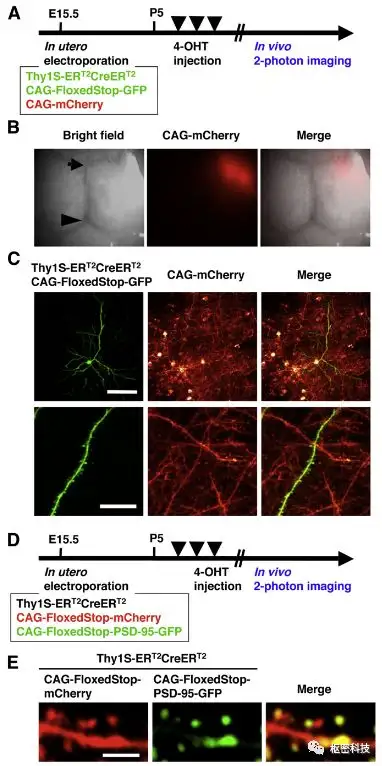
图 2. 多蛋白标记的单个神经元小鼠活体双光子成像[Ref 6] 。
2.2 Supernova:基于TRE泄漏的标记
Supernova系统结合了重组酶系统和Tet系统,利用TRE的不严谨,对早期发育和成体阶段的特定细胞类群标记。Supernova工作有以下几个步骤:1)仅有少数载体进入少数类群细胞,TRE泄漏后有少量重组酶表达(Cre, Flpe);2)重组酶剪切CAG-RT-stop-RT-XFP-tTA载体的RT-stop-RT序列(此时仅有几个拷贝),XFP和tTA发生低水平转录;3)与TRE结合,tTA促进重组酶表达;4)此时CAG-RT-stop-RT-XFP-tTA载体上更多拷贝的RT-stop-RT序列被重组酶剪切,XFP和tTA的表达上升;5)这样一个tTA/TRE的正向循环使得初始的少数细胞类群中,重组酶和XFP高水平表达,单个神经元的形态,包括树突棘,轴突分枝和终扣在内的细节都得到清晰的展示。
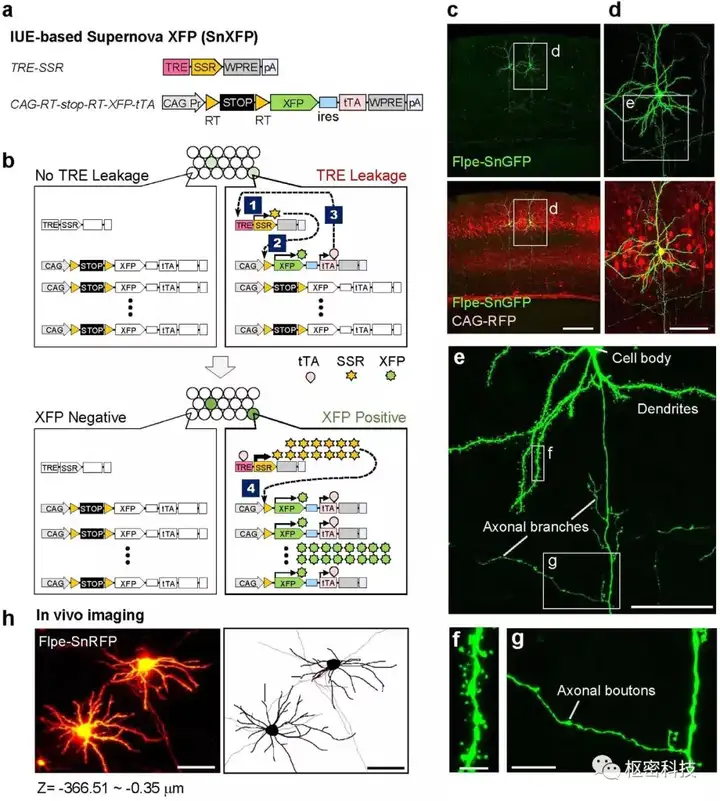
图 3. 基于TRE的低背景稀疏高亮标记[Ref 7 ] 。
现阶段,示踪病毒已被广泛用于环路研究和连接图谱的绘制。其中,可用于稀疏标记的病毒包括AAV、SFV、RV和VSV等。在特定脑区注射相应的病毒,报告基因表达一段时间后实现对特定脑区神经元的稀疏标记,之后光学成像分析神经元的精细结构,或者fMOST成像追踪单个神经元在全脑中的投射组。采用病毒标记需要注意的是,荧光信号不够亮时会导致神经元arbors细节丢失,可能影响真实路径的绘制,获得完整的神经元形态需要足够的标记强度;此外,优化病毒的注射量,控制在目标脑区的标记数量,能够显著区分出标记细胞。
目前,病毒工具结合重组酶系统的标记方法应用最为广泛,可观察和定量分析特定细胞类群,如胆碱能神经元的轴突和树突形态变化,同时对特定的疾病模型,如AD小鼠中的这类神经元进行表征。双病毒系统需要同时注射高度稀释的表达Cre的病毒以及较高滴度的Cre依赖的携带LoxP元件的荧光蛋白报告病毒。常见的AAV-Cre和 AAV-CreERT2病毒均可用于稀疏标记,使用AAV-Cre减少引入了4-OHT的操作。单病毒标记策略如使用嗜神经类的SFV,VSV,RABV和SINV等,同样是需要调整病毒注射量来获得理想的标记数量。
3.1. 基于Cre高倍稀释的方法
基于Cre高倍稀释的方法是通过调整病毒注射量,将目标区域的被高亮标记的神经元数目可控制在10-50个之间。该方法标记的细胞形态精美,并且可以在一定程度上追踪全脑的形态。
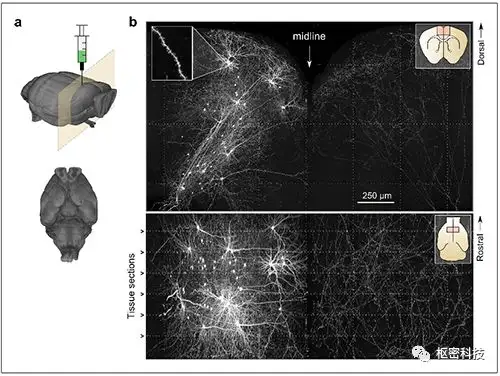
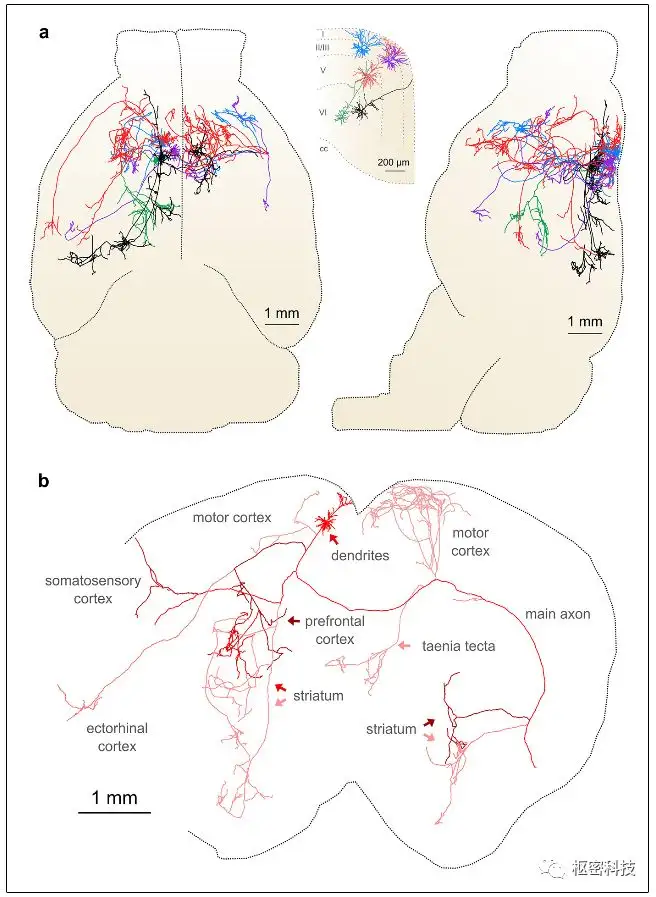
图 4. 基于Cre高倍稀释法标记追踪全脑形态[Ref 3 ] 。
3.2. AAV-supernova工具
利用IUE投递质粒及利用病毒工具均可搭载Supernova系统。除神经元投射组分析,稀疏标记也被用于谱系追踪。AAV-Supernova标记应用于在分裂后神经元,标记时程可长达8个月。但IUE-Supernova和AAV-supernova不适于对分裂的细胞进行标记,细胞在分裂过程中,载体被稀释,荧光强度也会受到影响。
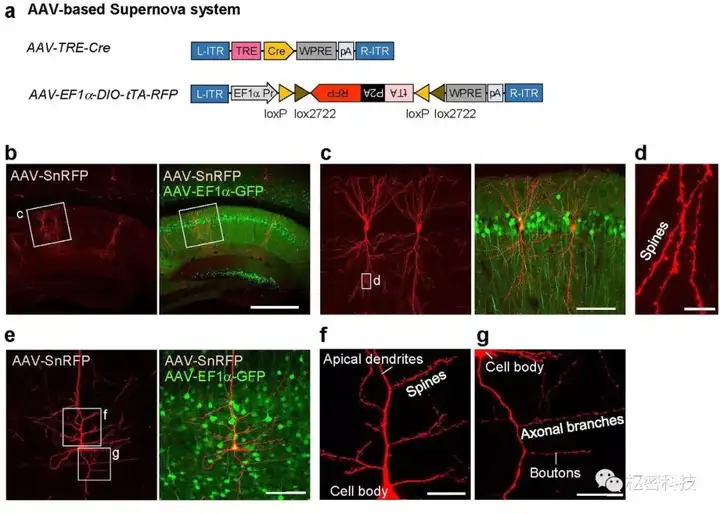
图 5. 小鼠海马CA1锥体神经元(b-d)和新皮层L5神经元(e-g)标记效果图[Ref 7] 。
3.3 RABV工具
狂犬病毒(Rabies Virus, RABV)的囊膜糖蛋白(glycoprotein, G)是其逆行跨突触所必需的蛋白,其受体大量分布在轴突末端,感染后可沿轴突逆行进入神经元胞体开启病毒复制,G蛋白缺失的RV(RV-ΔG)会丧失跨突触能力,复制及转录不受影响,外源基因仍可持续高丰度表达。因此,RV-ΔG携带报告基因后,其功能类似示踪染料CTB和retrobeads等,逆向高亮标记神经元精细形态,完成对标记神经元树突/轴突arbors的追踪和重构。补偿G蛋白后可辅助RV-ΔG逆行跨突触感染上一级神经元,实现跨单突触神经网络标记。利用Cre/Flp工具鼠结合对应的重组酶系统控制表达TVA及G蛋白的AAV辅助病毒,可实现只在特定区域特异类型神经元中表达TVA及G蛋白,从而利用RV-EnvA-ΔG实现对特异类型神经元的逆向跨单级突触标记。RV的这些特点能够较好地应用于稀疏标记,进行单色或多色成像。
3.4 SFV工具
森林脑炎病毒(Semliki Forest Virus, SFV)是正链RNA病毒,作为病毒生命周期和病毒性神经病变研究的模型,被广泛用于相关领域的研究。其广泛的宿主范围和高效的复制能力,可实现对神经元快速、稀疏、精细的标记,描绘神经元的精细形态,实时观测神经元的动态变化(树突棘、突触);用于辅助病毒,可快速高效的表达外源蛋白,结合功能探针可定向操控动物行为模式,研究特定神经网络的功能活动;利用病毒快速表达的特性,可表征动物对特定事件(神经迁移、疾病、学习、记忆)的编码(突触、神经网络连接)。
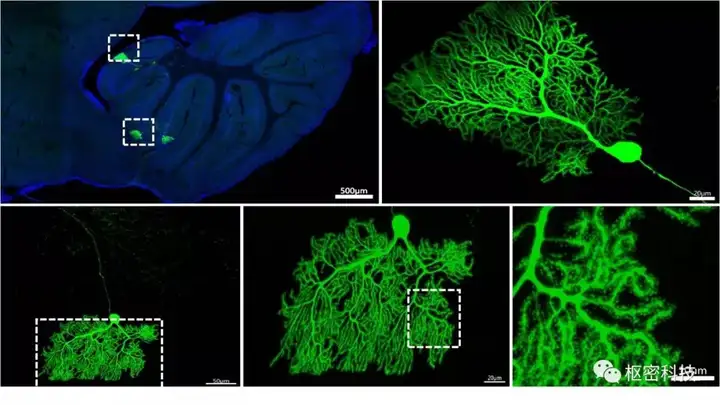
图 6. 脑立体定位注射小鼠SFV后,小脑中的浦肯野细胞被SFV标记 (Figure from Fuqiang Xu's lab, unpublished data)。
3.5 VSV工具
水泡性口炎病毒(Vesicular Stomatitis Virus, VSV),是有囊膜的单股负链RNA 病毒,具有复制及跨突触速度快,外源基因表达量高的特点,在大/小鼠动物模型中的神经回路示踪研究中广泛使用。G蛋白缺失后VSV丧失跨突触能力,但是基因组的复制及转录不受影响,因此VSV-ΔG病毒可用于快速获得神经元投射分布全貌及神经元的精细形态。
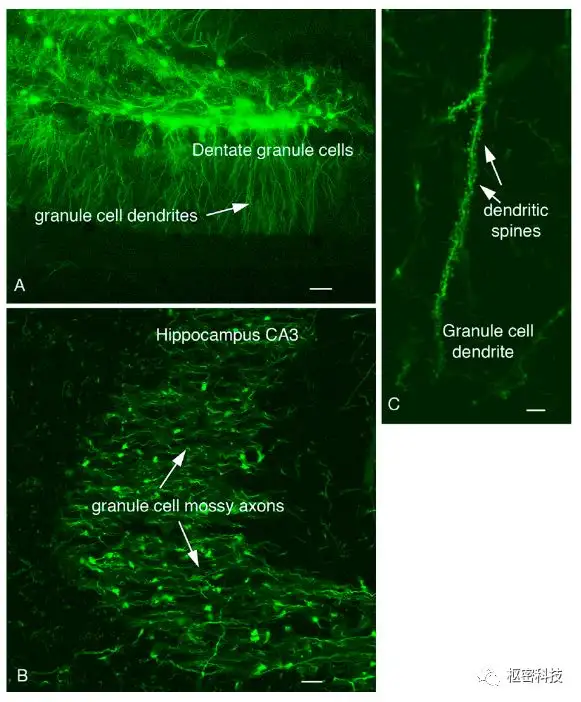
图 7. dG-VSV在海马齿状回注射(A),颗粒细胞树突棘高亮标记(B)。原文献中该实验的注射量是较高的,稀疏标记实验中需优化病毒稀释条件[Ref 12] 。
3.6 SINV工具
辛德毕斯病毒(Sindbis virus,SINV)是宿主广泛的正链RNA 病毒,能够在多种脊椎动物和无脊椎动物细胞中有效复制,可获得较高滴度的病毒。SINV适用于分裂期细胞,对有丝分裂后期细胞亦有效果。近年来,基于SINV 的各种载体得到开发,使用SINV载体对CNS系统进行标记时也可以获得轴突和树突棘等结构的精细显示。
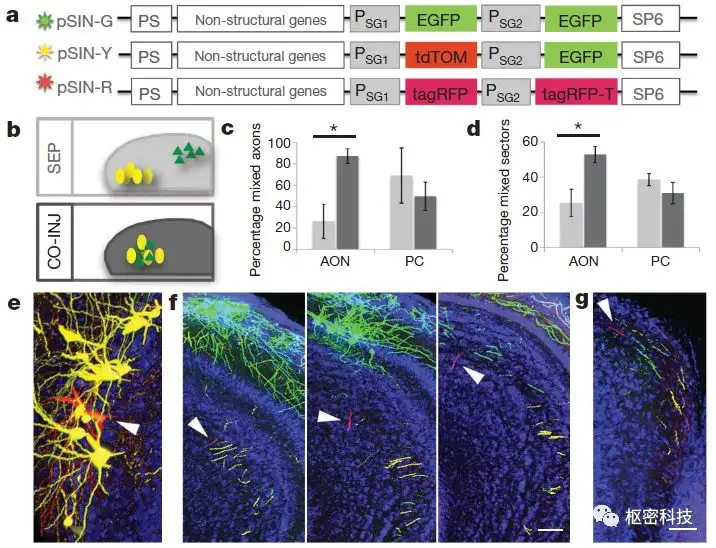
图 8. SINV标记显示AON及PC僧帽/丛状细胞长距离轴突[Ref 17]。
随机稀疏标记为解析神经细胞类型-环路-行为关联及建立大脑精细结构图提供了重要的方法,并与超薄切片成像很好的互为补充。传统的高密度标记难以获得的单细胞水平的形态功能信息和连续的投射路径追踪,基于转基因动物及示踪病毒标记的稀疏标记,辅以可在更大范围内更高分辨率的显微成像技术,在生理和病理状态下,揭示更多更精确的细胞类型-环路结构-行为之间关联的信息,为之后的疾病治疗提供可能。
References
[1]. PLoS One. 2013;8(2):e56144. doi: 10.1371/journal.pone.0056144.
Two-photon microscopy imaging of thy1GFP-M transgenic mice: a novel animal model to investigate brain dendritic cell subsets in vivo.
[2]. Neuron. 2000 Oct;28(1):41-51. PMID:11086982
Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP.
[3]. Elife. 2016 Jan 20;5:e10566. doi: 10.7554/eLife.10566.
A platform for brain-wide imaging and reconstruction of individual neurons.
[4]. Nature. 2012 Dec 13;492(7428):247-51. doi: 10.1038/nature11601.
Nonlinear dendritic integration of sensory and motor input during an active sensing task.
[5]. Int J Mol Sci. 2017 July; 18(7): 1461. doi: 10.3390/ijms18071461
Transgenic Strategies for Sparse but Strong Expression of Genetically Encoded Voltage and Calcium Indicators
[6]. Mol. Cell. Neurosci. 2011. https://doi.org/10.1016/j.mcn.2011.08.005
Simultaneous visualization of multiple neuronal properties with single-cell resolution in the living rodent brain.
[7]. Sci Rep.2016 Oct 24;6:35747. doi: 10.1038/srep35747.
Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo.
[8]. Sci Rep. 2017 Mar 8;7:43915. doi: 10.1038/srep43915.
Genetically-directed Sparse Neuronal Labeling in BAC Transgenic Mice through Mononucleotide Repeat Frameshift.
[9]. Brain Struct Funct. 2015;220(3):1369-79. doi: 10.1007/s00429-014-0730-z.
An anterograde rabies virus vector for high-resolution large-scale reconstruction of 3D neuron morphology.
[10]. Curr Opin Neurobiol. 2012 Feb;22(1):101-10. doi: 10.1016/j.conb.2011.09.010.
Sparse and combinatorial neuron labelling.
[11]. Neuron. 2011 Aug 25;71(4):617-31. doi: 10.1016/j.neuron.2011.07.005.
New rabies virus variants for monitoring and manipulating activity and gene expression in defined neural circuits.
[12]. J Comp Neurol. 2009 Oct 20;516(6):456-81. doi: 10.1002/cne.22131.
Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression.
[13]. Nature Methods. 2013 doi:10.1038/nmeth.264. Inducible control of gene expression with destabilized Cre.
[14]. Curr Opin Neurobiol. 2012 Feb;22(1):101-10. doi: 10.1016/j.conb.2011.09.010.
Sparse and combinatorial neuron labelling.
[15]. Nat Commun. 2016 Jul 4;7:12142. doi: 10.1038/ncomms12142.
High-throughput dual-colour precision imaging for brain-wide connectome with cytoarchitectonic landmarks at the cellular level.
[16]. Front Neuroanat. 2015; 9: 70. doi: 10.3389/fnana.2015.00070
Visible rodent brain-wide networks at single-neuron resolution.
[17]. Nature., 2011. 472, 217–220. doi:10.1038/nature09945
Sensory maps in the olfactory cortex defined by long-range viral tracing of single neurons.
如有相关需求,或了解更多产品服务,欢迎咨询我们!
点击进入店铺,查看更多产品及服务