武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【文献解读】《Nature Neuroscience》发现慢性疼痛伴发抑郁症的神经环路
3704 人阅读发布时间:2023-08-04 11:22
慢性疼痛伴发性抑郁症(Comorbid depressive symptoms, CDS)是一种常见的健康问题,但是调控这一症状的神经环路至今未知。临床上,慢性疼痛并发抑郁症的病人因为两种症状共存而变得极难治愈,同时抑郁症病人往往会出现长时间持续而剧烈的疼痛。疼痛与抑郁症之间往往形成一种恶性循环,找到能够有效治疗CDS的方法十分重要。
5-HT系统的功能紊乱与抑郁以及慢性疼痛均有关系,同时被认为调控痛觉感受。大脑中许多调控慢性疼痛脑区均接受5-HT的上调性投射,如丘脑,杏仁核,内侧前额叶皮层以及导叶皮层,但是对于中枢神经系统中慢性疼痛如何通过5-HT系统调控抑郁尚不清楚。然而,一些与慢性疼痛相关的大脑区域与抑郁症相关的区域重叠,如杏仁核和中缝背核(dorsal raphe nucleus, DRN)。
杏仁核复合体一直被认为是与恐惧记忆,焦虑以及疼痛相关,而中央杏仁核(CeA)被称为是“伤害性感受杏仁核”,是杏仁核功能的主要输出核团,接收来自丘脑,皮层以及脑干等多处的信号,同时也与前脑及脑干区域存在广泛的联系,以上都说明CeA调控恐惧以及情绪反应。
近日,中国科学技术大学张智团队在《Nature Neuroscience》上在线发表题为“A neural circuit for comorbid depressive symptoms in chronic pain”的研究论文,结果揭示了一条5-HTDRN→SOMCeA→GluLHb的神经环路,该新环路可能参与调控CDS发病的某些方面。

CeA中95%的神经元为GABA能神经元。作者首先使用Cre依赖的逆行型跨单突触示踪病毒来寻找CeA内GABA能神经元的上游投射。作者向GAD2-Cre小鼠的CeA注射Cre依赖的helper病毒(AAV2/9-Ef1α-DIO-TVA-GFP和AAV2/9-Ef1α-DIO-RVG),并于病毒表达3周后,向同位置注射RV(RV-ENVA-ΔG-DsRed)。结果显示,CeA除明显接收基底外侧杏仁核(BLA)、室旁下丘脑、丘脑的投射外,在DRN区域也存在强烈的红色荧光蛋白标记,说明DRN的GABA能神经元投射至CeA脑区。
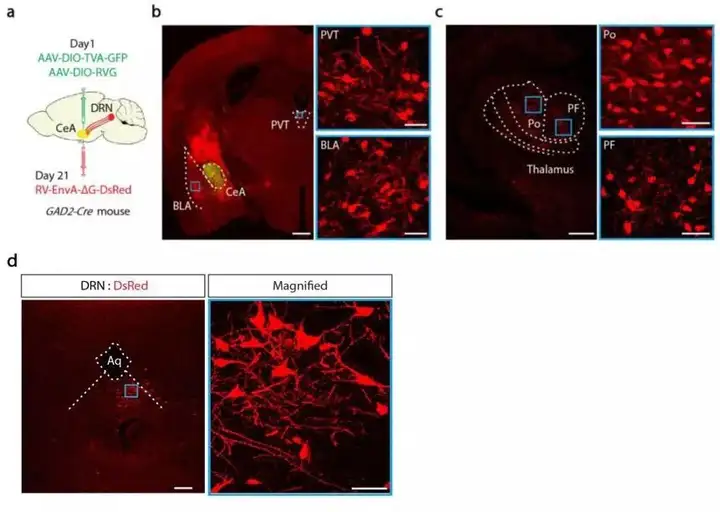
图1. DRN的GABA能神经元投射至CeA(modified)
接下来作者分别观察了DRN投射至CeA的表达小清蛋白(PV)、钙网膜蛋白(CR)以及生长激素抑制素(SOM)三种亚类型的GABA能神经元。结果显示,只有SOM-Cre小鼠的DRN存在红色荧光标记,PV-Cre以及CR-Cre的小鼠未发现。同时红色荧光可与5-HT阳性神经元的marker(TPH2)共标。作者向Pet1-Cre小鼠的DRN注射AAV2/9-DIO-ChR2-mCherry,4周后在CeA中发现携带mCherry的纤维末梢,DRN中投射至CeA对473nm的激光敏感的神经元中约95%是5-HT神经元,说明5-HTDRN→SOMCeA的投射是单突触的。
作者为明确5-HTDRN→SOMCeA的功能性连接,将SOM-Cre和Pet1-Cre与Ai9(RCL-tdT)小鼠杂交,使得表达SOM(SOM-tdTOM)和5-HT(Pet1-tdTOM)的神经元能够被标记继而方便急性脑切片的全细胞膜片钳实验。在显微镜下观察,来自DRN的神经纤维在CeA中主要定位于SOM神经元的近树突端和胞体之上。短暂的光刺激CeA中含有ChR2的5-HTDRN的突触末梢可引发SOM+神经元的超极化,同时该种细胞反应可被5-HT1A受体抑制剂WAY100635反转。免疫荧光实验也指出62.3%的5-HT1A受体存在于SOMCeA神经元中。
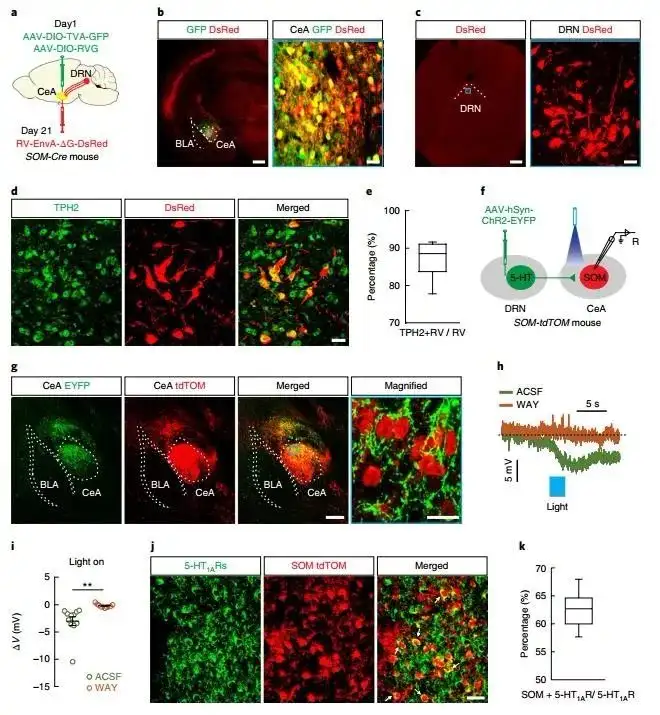
图2. 5-HTDRN与SOMCeA的连接
光刺激CeA中含有ChR2的5-HTDRN神经元末梢后,引起SOM-神经元的去极化反应,而该反应可以被5-HT2A受体的抑制剂MDL100907消除。同时,79.3%表达5-HT1A受体的神经元是SOM-神经元。光刺激所产生的反应与5-HT刺激产生反应相似。此外,CeA中光学激活5-HTDRN的末梢增加了SOM+神经元的微小突触后抑制电流(mIPSCs)的频率,而5-HT2A受体拮抗剂可逆转这一现象,同时这一反应也与灌注5-HT后的反应相似。综上所述,实验结果显示5-HTDRN向SOMCeA神经元的传入引起超极化,同时CeA中的SOM-神经元可支配并抑制SOM+神经元。
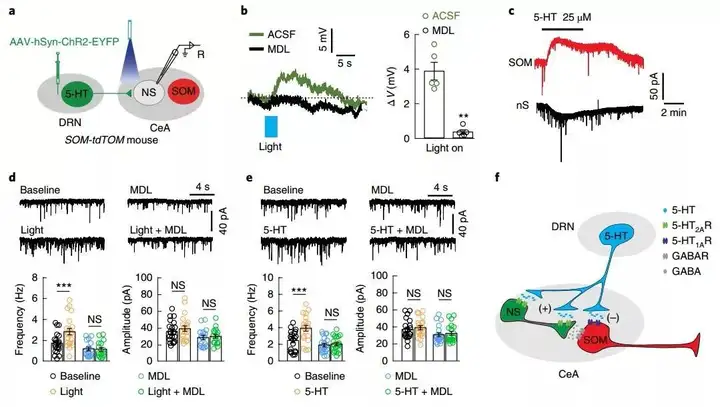
作者为评估5-HTDRN→SOMCeA神经通路在CDS中的作用,使用了两种被广发接受的慢性疼痛小鼠模型,保留性神经损伤(SNI)诱导的神经性疼痛模型以及完全佛氏佐剂(CFA)诱导的炎症性疼痛模型。SNI手术6周后小鼠在多种常规实验中表现出抑郁相关行为,在旷场实验(OFT)中心区域探索减少,高架十字迷宫实验(EPM)中开放臂探索减少,蔗糖偏好实验(SPT)中的兴趣缺失,以及悬尾测试(TST)中不动时间延长。相似的行为学表型也在CFA注射三周后出现。这些结果提示慢性疼痛模型可以有效地诱导出抑郁样行为。因为临床上多数抑郁症病例与神经性慢性疼痛相关,且难以治疗,所以作者选取在SNI小鼠模型上进行接下来的实验。
在Pet1-tdT小鼠的CeA中注射CTB-488逆行性示踪染料,使用全细胞记录的方法记录投射至CeA的5-HT神经元。结果显示SNI6周后小鼠的5-HTDRN神经元的电位发放减少了,说明6周的SNI会减少5-HTDRN的的神经活动,但是该种神经活动减少的现象却未在SNI2周的小鼠上出现。基于以上结果,作者使用在体微透析高效液相色谱法(HPLC)检测CeA中5-HT的含量。结果显示SNI6周的小鼠CeA中5-HT含量相较于假手术组明显减少。同时相似的结果也出现在CFA造模小鼠上。
作者猜想如果SOMCeA神经元可以被5-HTDRN的投射所抑制,那么在慢性疼痛模型中5-HTDRN神经元的输出将减少,从而导致SOMCeA神经元的去抑制。实验发现SNI6周后SOM+神经元的动作电位发放增多。为特异性抑制SOMCeA神经元,作者使用化学遗传学病毒AAV2/9-DIO-hM4Di-mCherry,并将其注射如SOM-Cre小鼠CeA中,腹腔注射给予CNO后,有效的减弱了抑郁样行为。
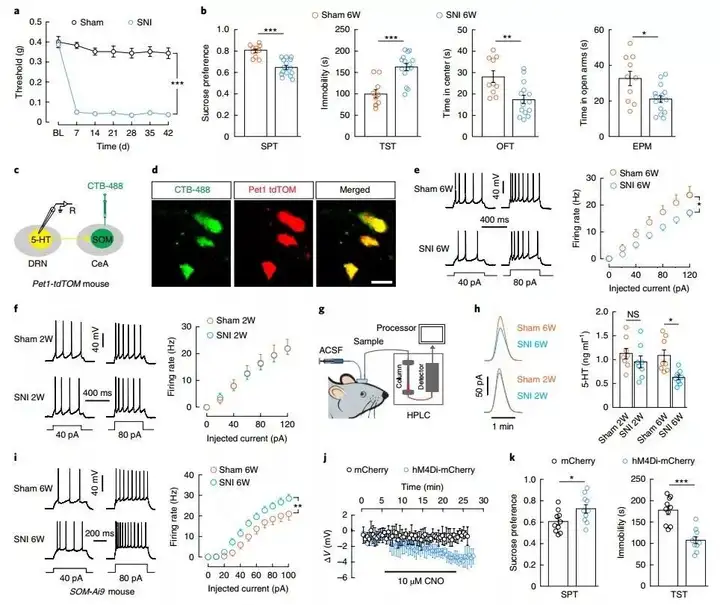
图4. 慢性疼痛模型小鼠中5-HTDRN→SOMCeA神经元输入减少
因为在持续性疼痛中5-HTDRN→CeA的输入减少,作者选用AAV2/8-DIO-hM3Dq-mCherry注射至Pet1-Cre小鼠的5-HTDRN神经元中。而后,实验发现同侧注射CNO后SNI诱导产生的抑郁样行为被明显的反转了,并且当向CeA中注射WAY时这种影响还可以被屏蔽。而当光学激活5-HTDNR的末梢时出现了相似的结果,同时减弱了SNI引起的疼痛。在NAÏVE组小鼠光学抑制CeA中5-HTDRN末梢也可有效诱导产生抑郁样行为。
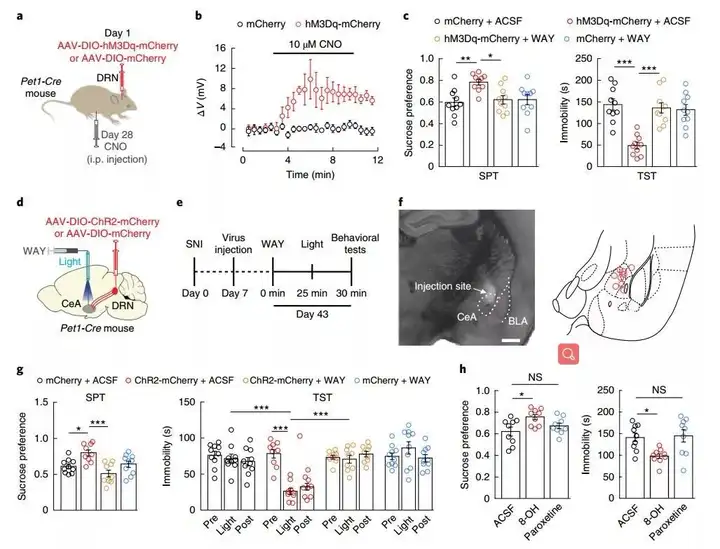
图5. 激活5-HTDRN→SOMCeA通路可降低慢性疼痛小鼠的抑郁样行为
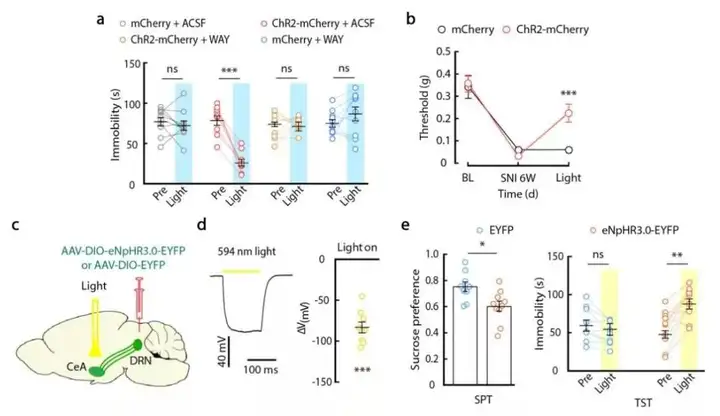
图6. 抑制5-HTDRN→CeA通路可产生抑郁样行为
为进一步验证该结果,作者向CeA中注射5-HT1A受体激动剂(8-OH)能够明显反转SNI小鼠的抑郁相关行为。但是该现象并未在向CeA中注射5-HT再吸收抑制剂(SSRI)帕罗西汀后出现。同时在慢性束缚应激(CRS)或反复的社交挫败(SDS)两种抑郁模型中5-HT的水平并无明显改变。而光遗传学激活5-HTDRN→SOMCeA环路后并没有反转以上两种操作造成的抑郁样行为。这些结果均说明5-HTDRN→SOMCeA神经通路仅对慢性疼痛引起的抑郁样行为具有功能,而在其他非疼痛小鼠抑郁模型中无效。
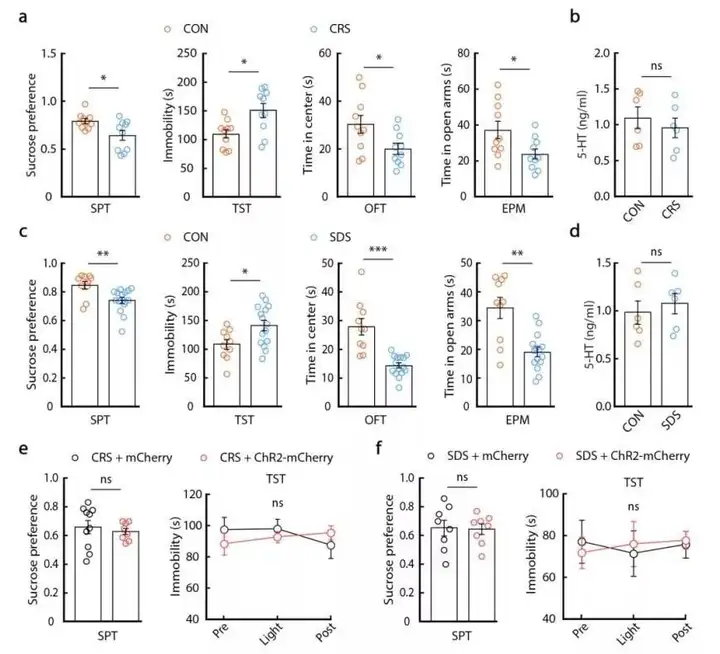
图7. 5-HTDRN→SOMCeA通路激活对慢性应激小鼠行为的影响
接下来作者着重于研究慢性疼痛模型下的调控小鼠抑郁样行为的5-HTDRN→SOMCeA神经通路的下游输出。作者向SOM-Cre小鼠的CeA注射AAV2/9-DIO-ChR2-mCherry后,在LHb脑区发现了mCherry+纤维,而该脑区在前人的报道中在病理生理学上参与调控抑郁症。光学激活LHb脑区的SOMCeA末梢后,脑片中所记录的25个神经元中有12个神经元同时出现EPSC和IPSC,11个神经元只有EPSC,其余2个只记录到IPSC。为了精细化分SOMCeA→LHb的神经元亚群,作者将Cre依赖的AAV-helper病毒和狂犬病毒(RV)注射入GAD2-Cre和CaMKII-Cre小鼠的LHb中。结果显示,仅在CaMKII-Cre小鼠的CeA发现红色荧光标记,而GAD2-Cre小鼠没有。免疫荧光双标结果显示红色荧光标记的CeA神经元中均被SOM以及VGLUT2标记。另外,82.9%的红色荧光标记神经元与5-HT1A受体共标,9.6%的神经元与5-HT2A受体共标。为验证以上结果,作者向CeA中注射AAV2/1-hSyn-Cre病毒,使得病毒能够顺行跨单突触进入神经元胞体,而后在同侧LHb注射AAV-DIO-GFP。病毒表达后,作者发现VGLUT2可与GFP标记的神经元共标。以上结果提示SOMCeA神经元向LHb的投射是谷氨酸能神经元,即GluLHb。同时,CaMKII-tdTOM小鼠的急性脑切片全细胞记录结果显示在SNI6周后GluLHb神经元的活动增强了。NAÏVE小鼠的LHb中的SOMCeA末梢在被光学激活后小鼠出现了抑郁样行为,而当光学抑制SNI6周的小鼠LHb中的SOMCeA末梢后,小鼠的抑郁样行为被有效缓解了。
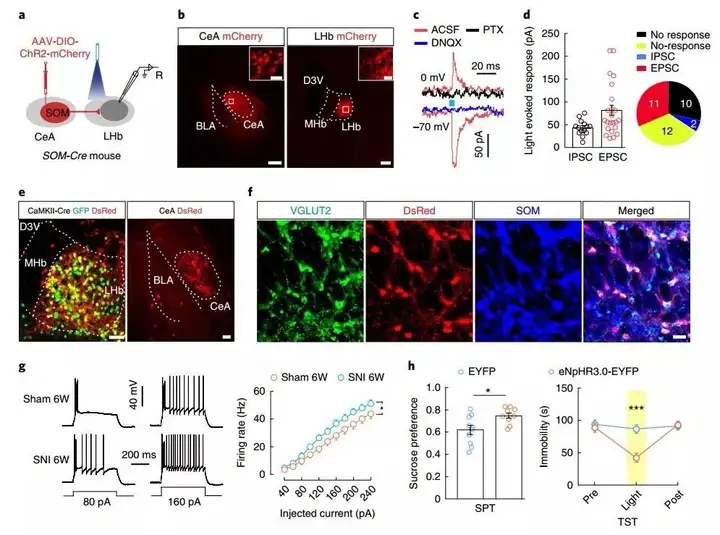
图8. LHb是5-HTDRN→SOMCeA神经通路的下游输出
为明确5-HTDRN→SOMCeA→GluLHb神经通路之间的联系,作者向LHb注射逆向运输的retroAAV(AAV2/2Retro-CMV-bGl-Cre-EGFP),从而使得SOMCeA的神经元胞体被感染表达Cre-GFP。同时Cre依赖的逆行型跨单突触示踪系统会紧随其后感染表达Cre酶SOMCeA神经元,在DRN中可以明显观察到红色荧光蛋白标记的5-HT阳性细胞胞体。
为了确定5-HTDRN→SOMCeA→GluLHb神经通路是功能性突触联系,作者将CTB-488注射入SOM-tdTOM小鼠的LHb标记SOMCeA投射向LHb的神经元,而后将AAV2/9-hSyn-ChR2-mCherry注射入DRN,并进行膜片钳记录。与5-HTDRN向SOMCeA神经元投射的情况相似,光学刺激CeA中的5-HTDRN纤维后引发CTB-488所标记的SOM+神经元的超极化,同时这种现象可被WAY所反转。在SNI6周的小鼠中SOM+神经元的活性增强。同时,灌注5-HT2A受体拮抗剂MDL后并不会影响CTB-488标记的SOMCeA神经元的膜电位。以上结果明确了远程和局部5-HTDRN→SOMCeA→GluLHb神经通路在人类CDS中发挥着调制作用。
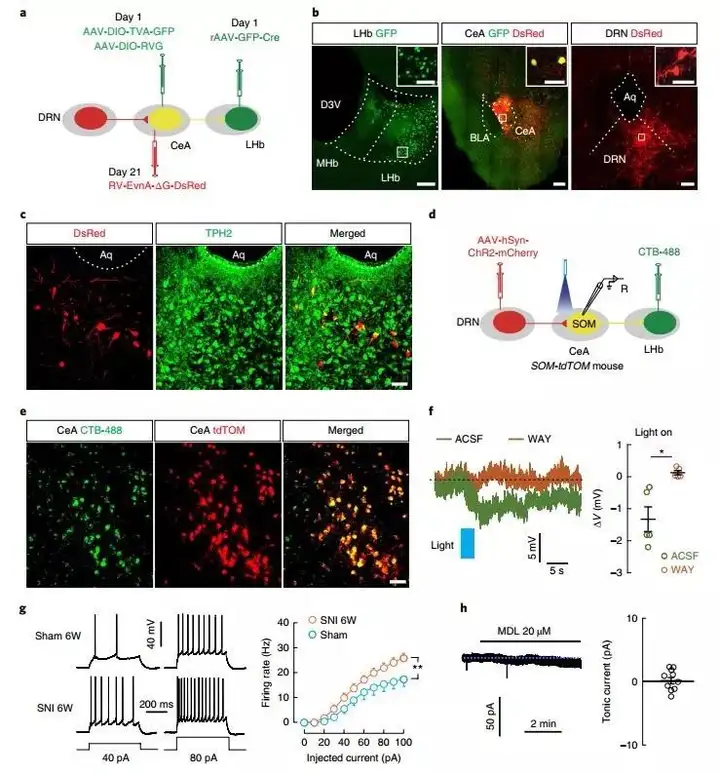
图9. 明确5-HTDRN→SOMCeA→GluLHb神经通路之间的联系
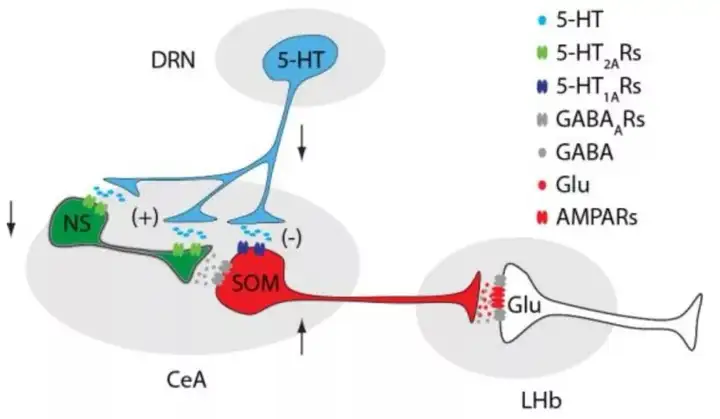
本研究佐证出一条新的神经环路,即中缝背核内5-HT阳性神经元(5-HTDRN)投射至中央杏仁核(CeA)中的生长激素抑制素(SOM)阳性中间神经元(SOMCeA)。SOMCeA投射至参与调控抑郁症的外侧缰核(LHb)。当抑制5-HTDRN→SOMCeA神经通路时慢性疼痛模型下的雄性小鼠出现抑郁样行为,而使用药理学或光遗传学方法激活这条通路时,该模型小鼠抑郁样行为被缓解了。在人类核磁共振成像的数据中,作者发现与健康对照组相比,存在慢性疼痛的抑郁症病人中他们的中央内侧杏仁核与DRN之间的功能性连接减弱,但是仅存在疼痛而不抑郁的病人中却没有这一现象。
团队使用了Cre-LoxP系统结合DIO启动的ChR2、eNpHR3.0、hM3Dq、hM4Di病毒(来自枢密科技),在转基因小鼠身上特异的去调控某种特定类型神经元的活性,同时使用狂犬病毒配合AAV-helper、使用特殊血清型的AAV1/2,AAV/retro以及CTB-488染料对小鼠的5-HTDRN→SOMCeA→GluLHb神经环路进行解剖学上的联系研究。
最终得出结论,5-HTDRN→SOMCeA→GluLHb神经环路在CDS的调控过程中是一条去抑制环路,可能参与调控CDS发病的某些方面。
原文连接:https://www.nature.com/articles/s41593-019-0468-2
如有相关实验需求,或了解更多产品服务,欢迎扫码咨询!