武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
【文献解读】Cell丨脑肠轴如何调控奖赏系统?
2092 人阅读发布时间:2023-06-14 10:49
酒足饭饱后,大脑会产生愉悦感,但究竟如何实现从消化系统到大脑的神经反馈,外周器官的信号是如何传导至中枢神经的奖赏系统等问题尚未阐明【1, 2】。在经典模型中,肠道迷走神经可以感受进食后的机械信号和化学信号并传输至尾部脑干,脑干再将信号传输至负责食物奖赏的中枢神经核团,从而调控进食【3,4】。另一方面,迷走神经还能将激素信息如缩胆囊素CCK发送至中枢神经系统【5】。近年来,越来越多的研究发现脑肠轴与奖赏【6】、焦虑、抑郁、认知密切相关。
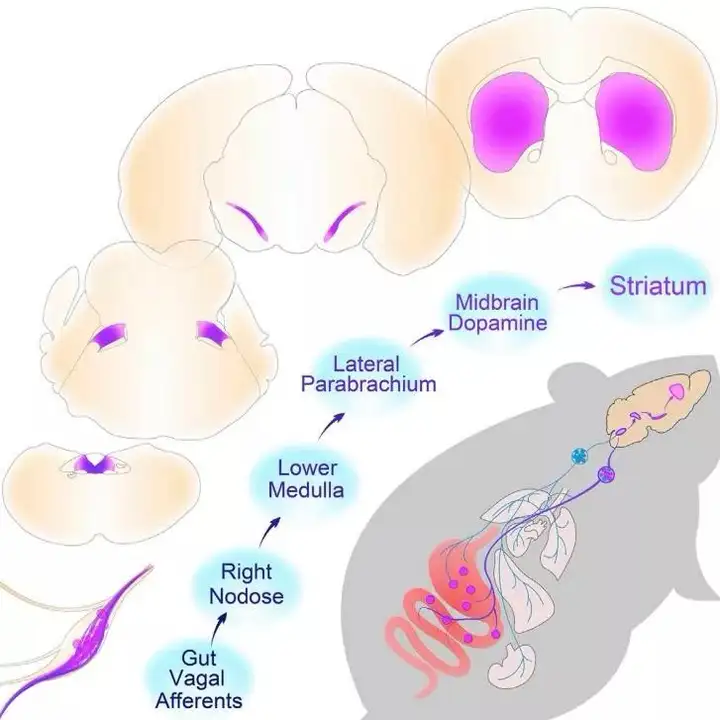
2018年9月20日,来自西奈山伊坎医学院的 Ivan E. De Araujo课题组在《Cell》上在线发表了题为“A Neural Circuit for Gut-Induced Reward”的研究成果。研究人员运用了大量的工具病毒来特异性标记和调控迷走神经-中枢神经通路,发现了激活上消化道感觉神经纤维可诱发奖赏行为,揭示了一条肠道迷走神经传入纤维(gut vagal afferents)→右侧结神经节(right nodose)→背外侧臂旁核(lateral parabrachium)→中脑多巴胺系统(midbrain dopamine)→纹状体(striatum)的介导调控奖赏的脑肠轴神经通路,解释了为何进食会使人产生愉悦感的神经机制。

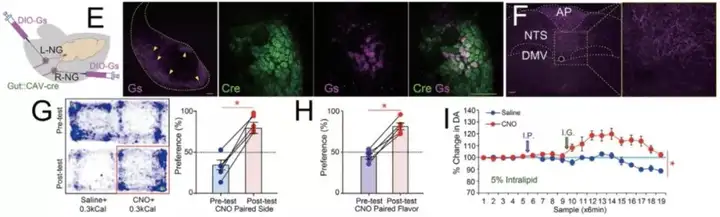
首先,本研究中的第一个挑战是如何特异性的调控肠道迷走神经的感觉纤维。为解决这个问题,研究者联合利用了两种病毒(图1 A):表达重组蛋白Cre的逆向追踪病毒AAVrg-pmSyn1-EBFP-Cre【7】和受Cre依赖的表达光敏蛋白ChR2的顺追病毒AAV-EF1a-DIO-hChR2(H134R)-EYFP。第一针AAVrg-pmSyn1-EBFP-Cre打在肠道后,病毒逆向感染双侧结神经节(nodose ganglia, NG),在NG表达Cre蛋白;第二针AAV-EF1a-DIO-hChR2(H134R)-EYFP打在右侧的NG(R-NG),由于ChR2 的表达依赖于 Cre,因此在众多 R-NG 神经元中,只有支配肠道感觉纤维的 NG 才能表达ChR2蛋白(图1 B,D)。电生理记录显示光刺激能诱发相应的动作电位(图1 C),验证该方法能激活分布在肠道的迷走神经的感觉纤维。
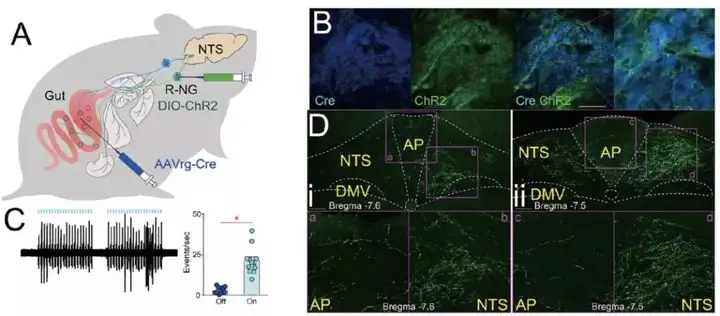
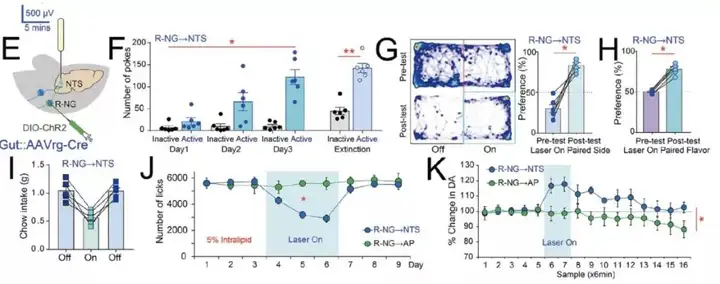
由于大量NG 的神经元末梢汇聚在孤束核(nucleus of the solitary tract, NTS),因此通过在NTS埋置光纤,给予 470nm 光刺激显著激活了低位脑干的神经元活动(图 2E)。随后,研究人员利用这些小鼠进行了一系列奖赏相关的行为学测试,发现激活 R-NG 末端强化了小鼠自刺激行为(自刺激行为是奖赏相关神经元激活直接导致的行为)。在实时位置偏好测试中,小鼠表现出更乐意待在有光刺激的一侧。同样,小鼠更倾向于选择与光刺激相匹配的味道。以上行为学测试共同说明了激活支配上消化道的感觉神经纤维能诱发奖赏。同时,研究人员利用微透析结合电化学方法发现激活支配上消化道的感觉神经纤维后,背侧纹状体(dorsal striatum, DS)中多巴胺的水平显著增加,这也进一步说明了R-NG与奖赏性神经元功能的相似性(图 2F-K)。
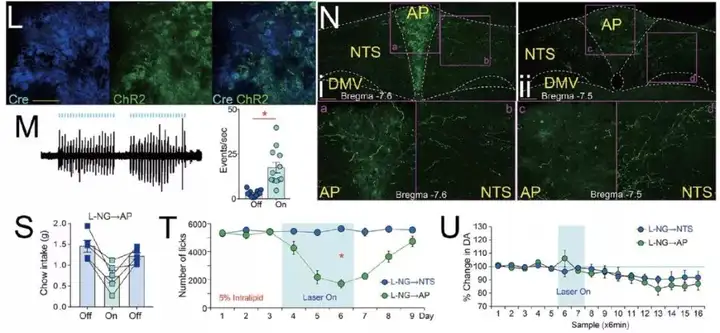
食物信号会同时刺激双侧NG的肠道感觉神经末梢,那么 L-NG 是否会对 R-NG 产生影响?同时调控双侧 NG 会产生什么效果?由于技术上的局限性,不能直接通过双侧光刺激的手段进行调控,因此选择了药理遗传学的手段,用药物敏感的离子通道进行神经元活性的调控【8】。病毒注射与之前类似,这次的第一针是表达重组蛋白 Cre 的逆向转运病毒CAV2-Cre-GFP,注射于十二指肠和胃感染迷走神经;第二针是 Cre 依赖的AAV-hSyn-DIO-rM3D(Gs)-mCherry注射在双侧NG(图 4E)。如此,腹腔注射 CNO 可同时激活双侧的 NG。随后进行的行为学测试表明,同时激活双侧 NG 后,小鼠的行为学表现、多巴胺水平与光激活单侧 NG 的表现一致(图 4G-I),提示 L-NG并不参与调控奖赏行为。
确定肠道感觉迷走神经→R-NG的结构和功能后,作者试图继续探索 NG 与黑质多巴胺神经元的联系。研究人员利用 Cre 诱导表达的跨突触的疱疹病HSV毒株H129△TK-TT注射在VGlut2-ires-Cre小鼠的 R-NG,在不同时间点观察荧光的分布情况。注射后48小时,背侧迷走复合体包括 NTS 被感染;注射72 小时后,感染扩散至 NTS 的下游,包括下丘脑室旁核(PVN)、背外侧臂旁核(PBNdl);感染 96 小时后,外侧黑质致密部(Substantia nigra, pars compacta, SNc)也可观察到感染后的荧光表达,且经免疫组化染色后发现,被感染的这部分 SNc 神经元中有一部分是多巴胺神经元(图5 A-G)。
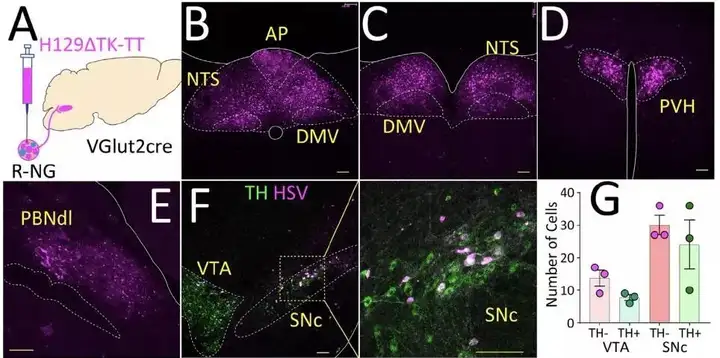
作者发现,在 SNc 注射逆追荧光染料后,大部分的荧光集中在PBNdl,图 5 中HSV 的感染也局限在PBNdl,PBNdl中 VGlut2 表达丰富【9】,由此推测PBN 的兴奋性神经元极有可能是连接迷走感觉末梢和 SNc 的关键脑区。作者运用了AAV-flex-ta-Casp3-TEVp和H129△TK-TT来验证猜想。AAV-flex-ta-Casp3-TEVp是 Cre 诱导表达 Caspase 蛋白的病毒,注射于VGlut2-ires-Cre小鼠的 PBNdl 3 周后,能使 PBNdl的VGlut2神经元充分表达Caspase,导致 PBNdl 神经元凋亡。随后在 R-NG 注射H129△TK-TT,不能在 SNc观察到荧光(图 6),说明PBNbl 的损害阻断了 R-NG 与 SNc的连接,由此证明 PBNdl 的VGlut2神经元是连接 R-NG 和 SNc 的重要纽带。
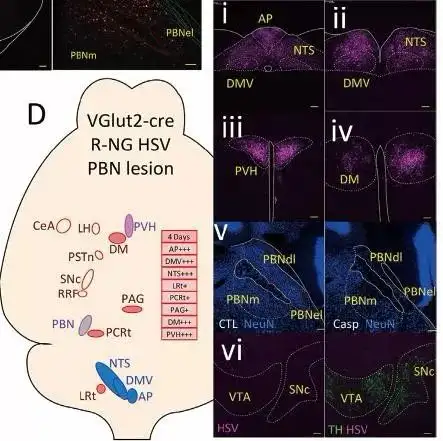
图6. i-iv.HSV 感染后不同脑区荧光表达;v.PBN 的NeuN 染色图;vi.多巴胺染色图
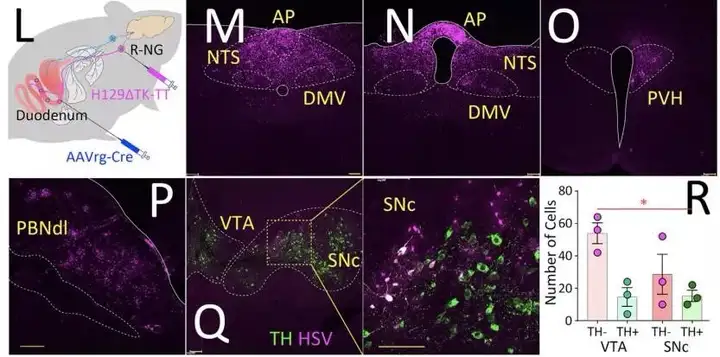
至此,作者确定了 R-NG→PBNdl→SNc 的纤维连接,那么这条环路是否与肠道感觉纤维相关联?作者又巧妙的运用了病毒工具来解决这个问题。通过在胃部和十二指肠注射AAVrg-pmSyn1-EBFP-Cre,3周后在 R-NG 注射Cre 依赖的H129△TK-TT,发现在 PBNdl 和外侧 SNc均有荧光表达,说明了肠道感觉纤维与 R-NG→PBNdl→SNc的连接,用此方法追踪到的SNc荧光表达神经元同样也与多巴胺存在共定位,且数量相当(图 7 L-R)。
已有文献报道,PBNdl与避害行为相关【10】,而本研究发现,在R-NG→PBNdl→SNc通路中,PBNdl 与肠道引起的奖赏有关,因此作者猜测,PBNdl的不同神经元同时负责了奖赏和避害行为。通过灌胃合适浓度的缩胆囊素(CCK)和氯化锂(LiCl)来分别诱发愉悦和厌恶的肠内反应【11】后进行 Fos染色发现,虽然给予CCK 和 LiCl后,进食量都下降了将近 50%,但是PBNel 中的 Fos 表达分布截然不同。LiCl组Fos 表达主要分布在PBNel,CCK组Fos 表达则主要分布在PBNdl,在PBNdm也有少量分布。
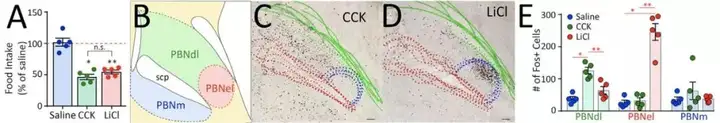
基于这种功能上的差异,作者猜测 PBNdl 和 PBNel靶向不同的下游脑区。果然,顺追染料PHA-L的荧光结果表明,PBNdl 投射至SNc,而 PBNel 投射至中央杏仁核亚区。

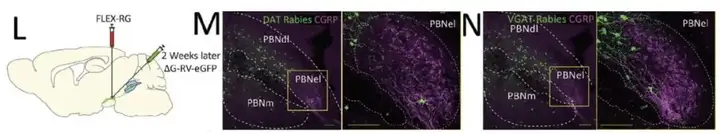
之前免疫染色结果显示在R-NG→PBNdl→SNc通路中,SNc 有部分神经元与多巴胺有共定位,为了进一步确定PBNdl 与 SNc 投射的细胞特异性,作者利用了DAT-ires-Cre、 VGat-ires-Cre Mice转基因小鼠和Cre-依赖的逆行跨单突触狂犬病毒(RV)【12】。RV能够示踪上游脑区。先将AAV5-EF1a-FLEX-TVAmCherry注射于 SNc 表达 2 周,再在同一位置注射△G-RV-EGFP,发现在两种转基因小鼠的 PBNdl有追踪信号,提示 PBNdl 的 VGlut2 神经元是 SNc 的上游核团。
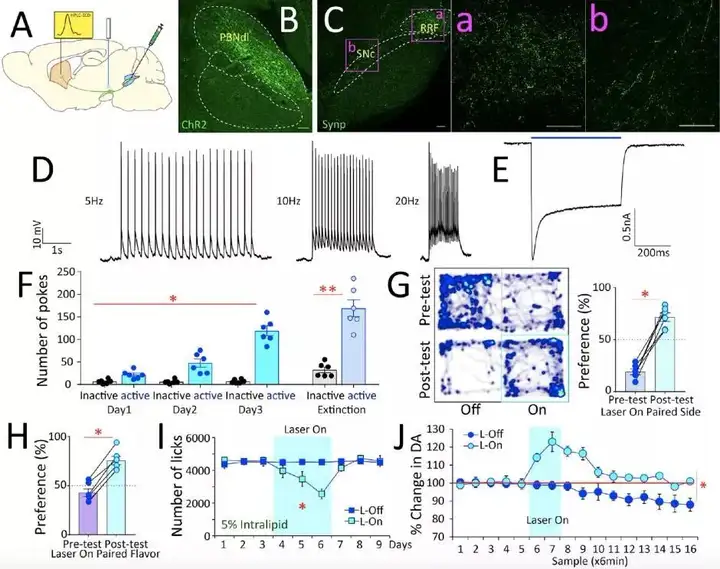
将AAV-EF1a-DIO-hChR2(H134R)-EYFP注射于VGlut2-ires-Cre 小鼠的 PBNdl,可特异性的使 PBNdl 中VGlut2 神经元和突触末梢表达ChR2,脑片电生理记录SNc 神经元活动显示,光刺激能诱发相应频率的动作电位,证实光激活 PBNdl→SNc的可靠性(图 11 A-E)。在 PBNdl 上方埋置光纤,检测行为学发现,在实时位置偏好测试中,小鼠表现出更乐意待在有光刺激的一侧。同样,小鼠更倾向于选择与光刺激相匹配的味道,引起了饱腹感,且多巴胺水平随之上调(图 11 F-J),这一表现与激活R-NG后行为相似,进一步说明了通路的连贯性。
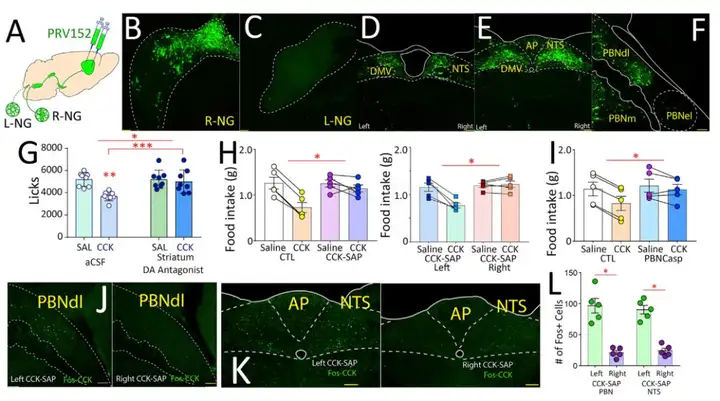
作者通过将逆行跨多突触的 PRV152-GFP 注射到双侧DS中来确认R-NG → PBNdl→ SNc 通路的存在(图12 A-F)。当在 R-NG给予多巴胺受体拮抗剂,阻滞肠道感觉神经右侧R-NG传入,损害 PBN-SNc 通路后,CCK不能引起饱腹感,说明 R-NG→PBNdl→SNc通路是肠内营养素感知、信号传输的必经之路,Fos 的表达分布也进一步验证了这个结论(图12 G-L)。
综上,本文通过巧妙运用大量的工具病毒,揭示了一条肠道迷走神经传入纤维→右侧结神经节→背外侧臂旁核→中脑多巴胺系统的介导调控奖赏的脑肠轴神经通路(图 13),验证了脑肠轴在奖赏机制中的作用,并发现了左右侧神经节结构和功能的不对称性。
枢密目前拥有先进、全面的病毒载体技术平台,及严格的病毒分级纯化工艺和多项QC检测标准,病毒工具库丰富,包含该实验中用到的所有病毒工具。
| AAVrg-pmSyn1-EBFP-Cre | AAV5-flex-taCasp3-TEVp |
| H129△TK-TT | AAV5-EF1a-FLEX-TVAmCherry |
| △G-RV-EGFP | AAV8.2-hEF1a-DIO-synaptophysin-EYFP |
| AAV5-EF1a-DIO-hChR2(H134R)-EYFP | CAV2-Cre-GFP |
| AAV5-EF1a-DIO-EYFP | PRV152-GFP |
| AAV-hSyn-DIO-rM3D(Gs)-mCherry | PRV614-RFP |
原文链接:https://www.sciencedirect.com/science/article/pii/S0092867418311103
参考文献
http://1.de Lartigue, G. and C. Diepenbroek, Novel developments in vagal afferent nutrient sensing and its role in energy homeostasis. Current opinion in pharmacology, 2016. 31: p. 38-43.
2.Berthoud, H.r., Vagal and hormonal gut–brain communication: from satiation to satisfaction. Neurogastroenterology & Motility, 2008. 20: p. 64-72.
3.Prechtl, J.C. and T.L. Powley, The fiber composition of the abdominal vagus of the rat. Anatomy and embryology, 1990. 181(2): p. 101-115.
4.Schwartz, G.J., The role of gastrointestinal vagal afferents in the control of food intake: current prospects. Nutrition, 2000. 16(10): p. 866-873.
5.Berthoud, H.R., Vagal and hormonal gut-brain communication: from satiation to satisfaction. Neurogastroenterol Motil, 2008. 20 Suppl 1: p. 64-72.
6.Han, W., et al., A neural circuit for gut-induced reward. Cell, 2018. 175(3): p. 665-678. e23.
7.Tervo, D.G.R., et al., A designer AAV variant permits efficient retrograde access to projection neurons. Neuron, 2016. 92(2): p. 372-382.
8.Sternson, S.M. and B.L. Roth, Chemogenetic tools to interrogate brain functions. Annual review of neuroscience, 2014. 37: p. 387-407.
9.Williams, E.K., et al., Sensory neurons that detect stretch and nutrients in the digestive system. Cell, 2016. 166(1): p. 209-221.
10.Carter, M.E., et al., Genetic identification of a neural circuit that suppresses appetite. Nature, 2013. 503(7474): p. 111.
11.Diepenbroek, C., et al., Validation and characterization of a novel method for selective vagal deafferentation of the gut. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2017. 313(4): p. G342-G352.
12.Banfield, B.W., et al., Development of pseudorabies virus strains expressing red fluorescent proteins: new tools for multisynaptic labeling applications. Journal of virology, 2003. 77(18): p. 10106-10112.
如有相关实验需求,或了解更多产品服务,欢迎扫码咨询!