武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
《Nature Communications》∣华科同济医学院王建枝、杨莹团队发现新的抗焦虑神经环路
967 人阅读发布时间:2023-06-14 10:25
情绪和决策是日常生活中不可或缺的部分,它们之间相互影响,在帮助人们适应压力环境并影响着他们的独特生命。适当的焦虑情绪能使个体免于伤害,但当个体患有焦虑症(最常见的适应不良情绪)时,他们通常会采取回避行为而不是对现场一探究竟,然而越是回避他们就越不能获得真实情况有时并不像他们所担心的那么可怕,因而更加焦虑,形成恶性循环1-3。此外,趋向行为的减少使得他们对先前恐惧心理的消除能力下降,也加剧了焦虑4-5。目前关于调控“趋向”或“回避”行为的神经环路机制仍然是不清楚的。
2020年1月10日,华中科技大学同济医学院基础医学院王建枝、杨莹团队在《Nature Communications》上在线发表了题为“Posterior basolateral amygdala to ventral hippocampal CA1 drives approach behaviour to exert an anxiolytic effect”的研究成果。该研究揭示了一条杏仁核基底外侧核后部(pBLA)-腹侧海马CA1区(vCA1)之间的神经环路,此环路通过调控趋向行为来发挥抗焦虑作用,为焦虑疾病的治疗提供了新线索。

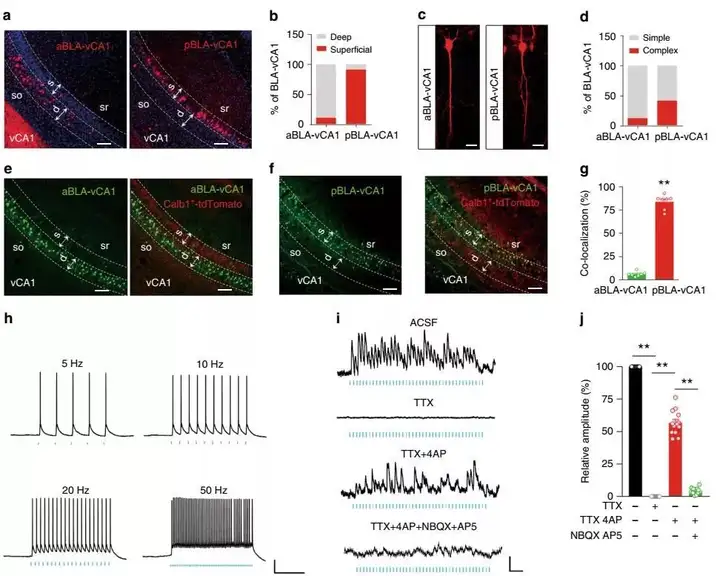
1、a/pBLA沿vCA1的浅轴至深轴支配vCA1锥体细胞(PC)。
为了验证从aBLA和pBLA到vCA1的直接单突触环路连接存在结构异质性,团队使用了顺行跨单突触神经示踪病毒(H129-ΔTK-tdT)发现在vCA1浅层中观察到约91%的来自pBLA的投射信号,而在vCA1的深层中观察到约89%的来自aBLA的投射信号(图1a, b)。大约41%的pBLA–vCA1神经元具有双尖顶树突,而约88%的aBLA–vCA1神经元仅具有单个树突(图 1c, d)。钙结合蛋白-1(Calbindin1,Calb1)是海马浅层的神经元Marker之一。为了进一步研究vCA1Calb1+神经元是否是pBLA投射的靶标,在Calb1-IRES2-Cre-D :: Ai9小鼠中使用顺向跨突触病毒追踪了aBLA–vCA1和pBLA–vCA1的环路发现pBLA–vCA1的神经元~84%是Calb1+,而aBLA–vCA1的神经元~95%是Calb1–(图1e-g)。接下来,通过离体膜片钳记录发现pBLA–vCA1Calb1 +环路是谷氨酸能介导的单突触环路连接(图 1h-j)。这些数据一起表明从pBLA到vCA1 的Calb1+神经元建立了单突触兴奋性连接,从aBLA到vCA1 的Calb1–神经元建立了单突触兴奋性连接。
2. a/pBLA–vCA1环路输入在焦虑行为中发挥异质性
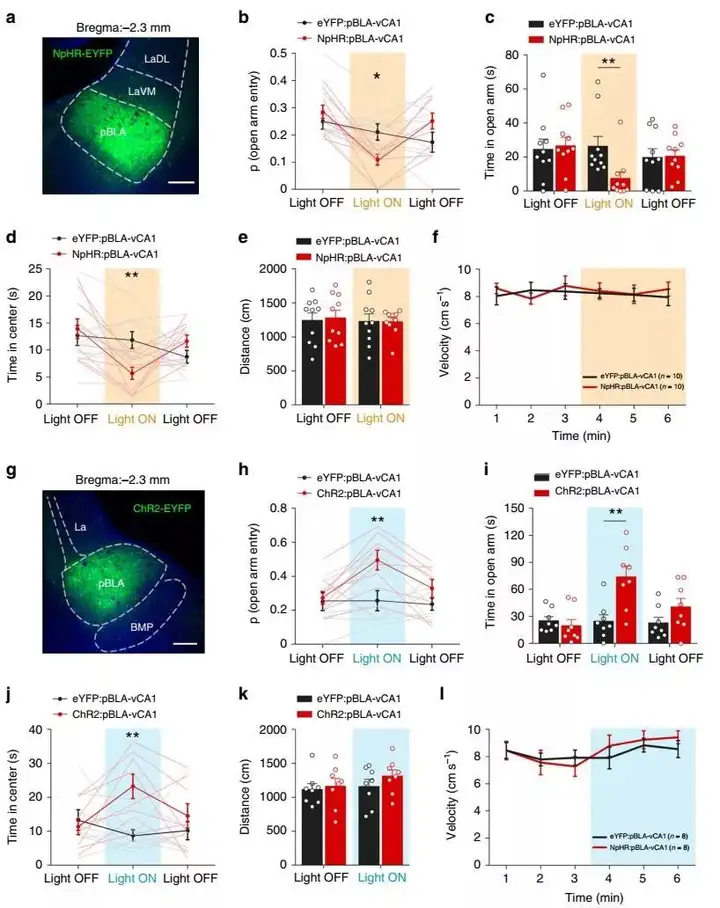
团队进一步研究了pBLA–vCA1和aBLA–vCA1环路在调节焦虑情绪中存在功能异质性。首先,将光遗传学病毒(AAV5-CaMKIIa-eNpHR3.0-EYFP或AAV5-CaMKIIa-hChR2(H134R)-EYFP)注射到pBLA中,并在vCA1的双侧植入光纤,以通过传输蓝光或黄光将其靶向pBLA–vCA1的轴突末梢。在十字高架迷宫(EPM)和旷场测试(OFT)中记录小鼠的趋向和回避行为,目前这种冲突探索任务公认用于评估焦虑。结果,出乎意料地观察到在光抑制期间,与EYFP对照小鼠相比,pBLA-vCA1-NpHR组的小鼠探索EPM开放臂的频率要低得多,并且在OFT的中心区域停留较短,表明光抑制pBLA–vCA1环路时焦虑相关行为增加。但是,光激活pBLA-vCA1-ChR2小鼠则显著增加了开放臂的探索时间和频率,进入OFT的中心区域时间增加,这表明光激活pBLA–vCA1环路时减轻了焦虑。在EPM和OFT范式中,对pBLA–vCA1输入的操纵过程中未检测到运动变化。这些数据表明pBLA–vCA1环路驱动趋向发挥抗焦虑作用(图2)。
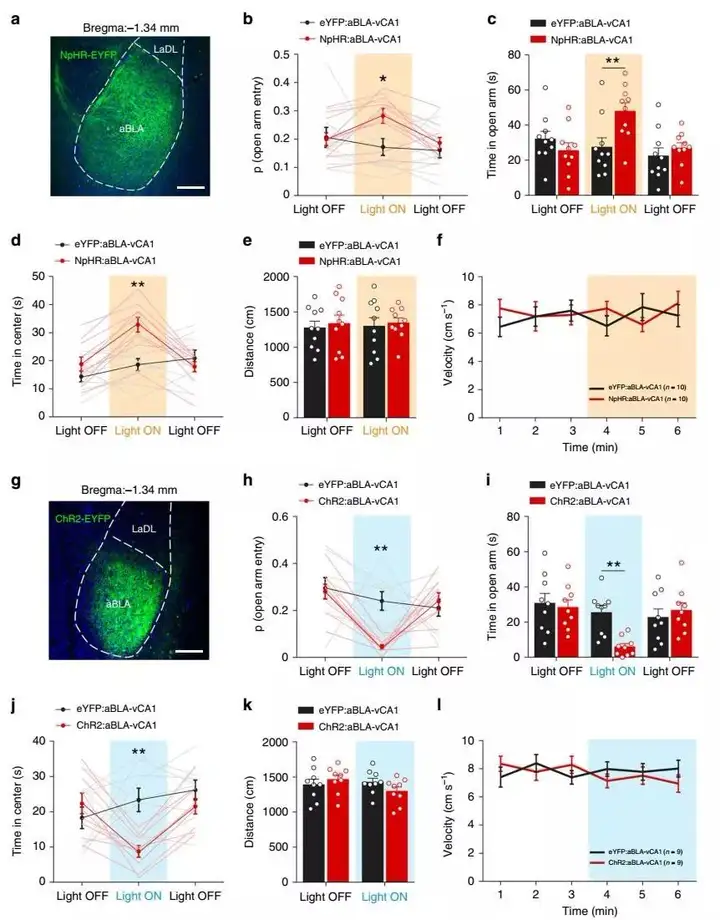
随后,团队关注在aBLA–vCA1环路中以探索其在焦虑相关行为中的作用。结果表明,在光激活期间显著减少了EPM开放臂和OFT中心区域的探索,同时表现出较少的趋向行为或较多的回避行为。但是,在EPM和OFT中对aBLA–vCA1环路的光抑制显著增加了开放臂和中心区域的探索,同时在各组之间均未检测到运动差异。以上结果表明aBLA–vCA1环路促进回避行为引起焦虑效应(图3)。
这些数据表明pBLA-vCA1和aBLA–vCA1环路在调节焦虑行为中的作用相反。
3. vCA1Calb1+神经元调控趋向行为
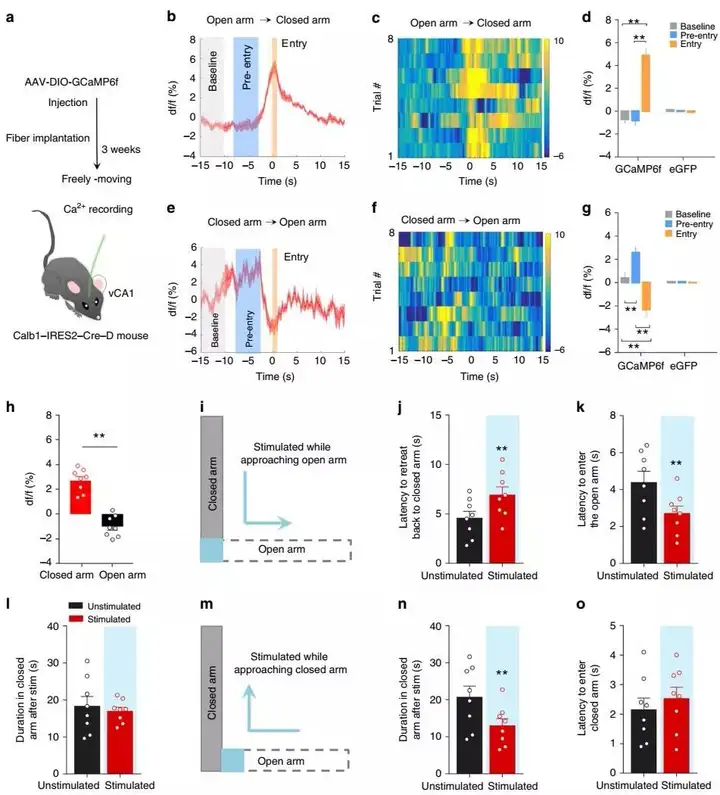
为了探索光激活pBLA–vCA1环路在冲突情况下决策过程中的抗焦虑作用的潜在机制,团队分析了在冲突探索任务中自由活动小鼠的vCA1Calb1+神经元的放电活性 (图 4a)。使用Cre依赖性策略在vCA1Calb1+神经元中表达GCaMP6f或GFP载体,发现 pBLA优先支配的vCA1Calb1+神经元的激活涉及回避或趋向决策(图 4a-h)。为了进一步研究vCA1Calb1+神经元如何驱动趋向行为,团队建立了一个L型高架迷宫,当vCA1Calb1+-ChR2小鼠接近开放和闭合臂之间的边界时,通过向vCA1Calb1+-ChR2小鼠传递短暂的光刺激 (2 s , 8 mW) 来特异性靶向vCA1Calb1+神经元。当从闭合臂移动到开放臂时,过渡区域的光活化显著增加了退回闭合臂的潜伏期,减少了进入开放臂的潜伏期,并且对闭合臂的停留时间没有影响。然后,当它们从开放臂移动到闭合臂时,对它们进行了类似的刺激方案。在这种情况下,光刺激减少了闭合臂的停留时间(图 4n),并且对进入闭合臂的潜伏期没有影响。这些数据表明,vCA1Calb1+神经元在冲突探索任务中采取决策方式偏于趋向(图 4i-o)。
以上数据共同表明,vCA1Calb1+神经元通过控制趋向-回避行为模拟了pBLA–vCA1环路的抗焦虑作用。
4. 光激活pBLA–vCA1Calb1+环路可减轻APP/PS1小鼠的焦虑
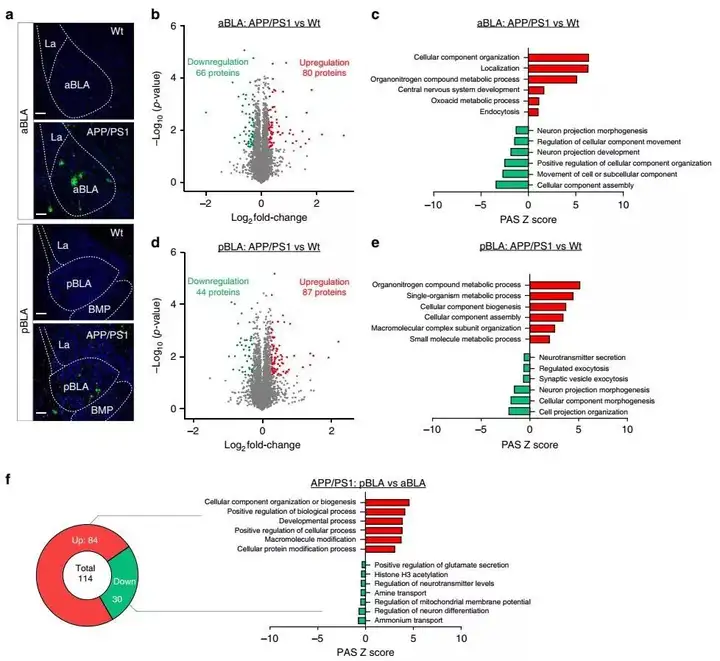
先前的研究表明,BLA中的β-淀粉样蛋白(Ab)聚集增强了AD转基因小鼠的焦虑样行为。为了探索aBLA或pBLA是否与AD相关的焦虑症有关,首先,团队研究了携带突变的APP和PS1基因的APP/PS1小鼠的aBLA和pBLA中的病理性Ab,它们在大脑中产生过量的Ab。与年龄和性别相匹配的野生型对照组相比,APP/PS1小鼠(6 月龄大)在6E10染色中检测到pBLA和aBLA中神经元内的Aβ和神经元外的淀粉样斑块(图 5a)。
为了进一步了解小鼠中aBLA和pBLA之间的差异,进行了无偏蛋白质组分析(图 5b-f,)。将APP/PS1小鼠与野生型对照组进行了比较,相对于野生型小鼠的水平,发现AD 的aBLA中增加了80种蛋白质,减少了66种蛋白质,而在AD 的pBLA中增加了87种蛋白质,减少了44种蛋白质(图 5b,d)。GO分析表明,与野生型小鼠相比,APP/PS1小鼠的aBLA和pBLA中单一生物过程,生物调节,细胞成分组织和代谢过程是上调的首要项目(图 5c, e)。相比之下,aBLA中的单生物发育过程,细胞过程的正向调节,细胞成分的生物发生等被下调,而pBLA中的解剖结构形态发生,细胞发育,对化学物质的反应等被下调(图 5c, e)。这些数据一起表明,aBLA和pBLA之间的蛋白质网络差异可能是导致它们对AD中Aβ病理的独特反应。
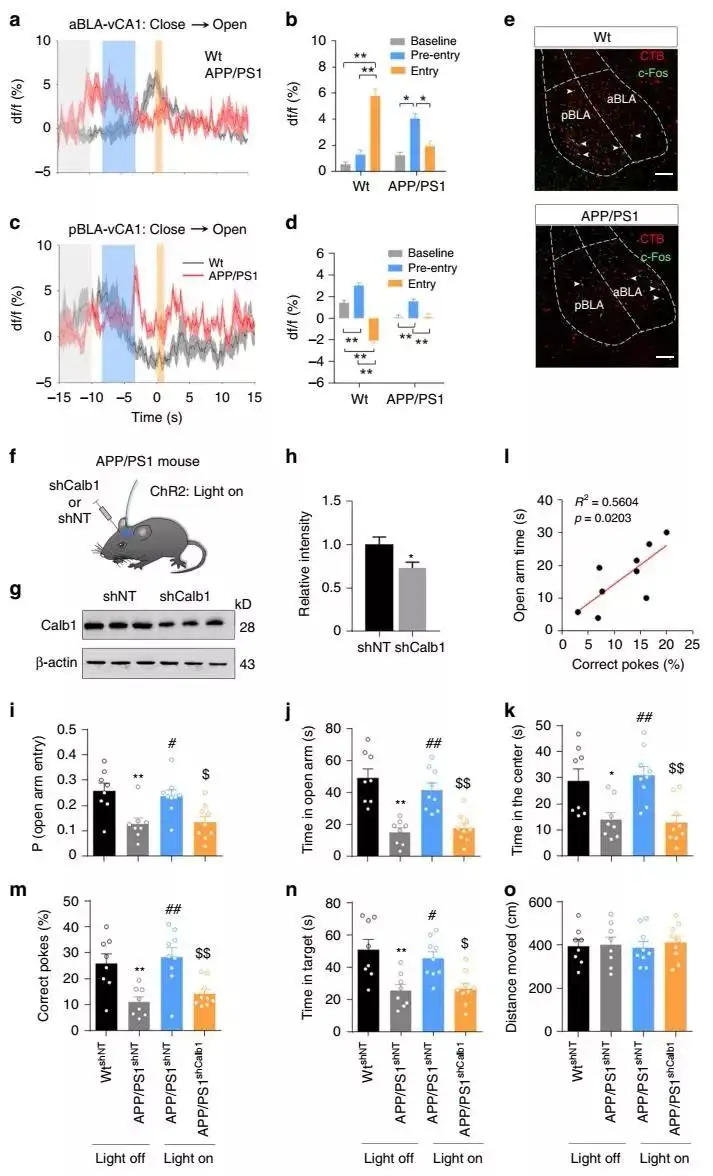
然后,团队探究了aBLA–vCA1和pBLA–vCA1环路在AD中如何变化,以及它们是否参与AD焦虑症。通过将rAAV-hSyn-Cre注入vCA1和AAV-EF1a-DIO-GCaMP6f分别注入aBLA和pBLA中,实现 GCaMP6f精确地表达在aBLA和pBLA神经元中,且可以支配vCA1神经元。在趋避冲突情况下,AD中的aBLA–vCA1和pBLA–vCA1环路出现了异常活化(图 6a-d)。紧接着使用逆向追踪剂(CTB-555,霍乱毒素亚基B)和c-Fos联合染色来评估EPM测试期间APP/PS1小鼠中aBLA–vCA1和pBLA–vCA1环路的总体变化,发现pBLA–vCA1环路的激活不足打破了aBLA–vCA1和pBLA–vCA1之间的平衡(图 6e)。当光激活pBLA–vCA1环路可以减轻AD小鼠的焦虑和记忆障碍,有趣地是,发现在6-8月龄的 APP/PS1小鼠中,焦虑状态与空间记忆缺陷呈现显著相关性。为了探索Calb1在pBLA–vCA1环路的抗焦虑效应中的作用,团队将AAV-shCalb1注射到APP/PS1小鼠的vCA1中来下调Calb1,消除了光激活pBLA–vCA1环路的抗焦虑作用,同时也消除了AD记忆障碍的改善(图6f-o)。这些数据表明,AD小鼠中pBLA–vCA1Calb1环路的损伤与焦虑和记忆障碍有关,并且pBLA–vCA1Calb1环路的激活可以以Calb1依赖的方式挽救与焦虑相关的记忆障碍。
总结
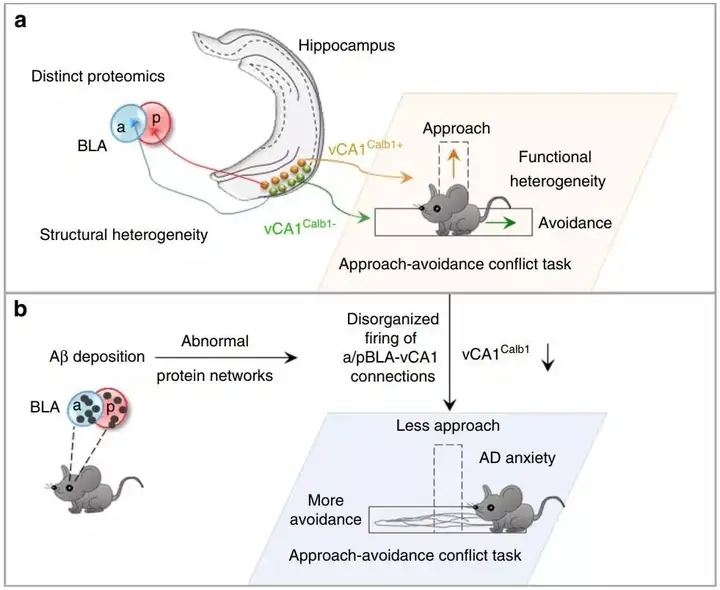
团队使用了枢密科技的病毒工具,通过联合应用神经环路示踪、电生理记录、光遗传学、在体光纤记录等技术,发现了aBLA主要支配vCA1深层的钙结合蛋白阴性神经元(Calb1-),而pBLA主要支配vCA1浅层钙结合蛋白阳性神经元(Calb1+),采用光遗传学技术激活aBLA-vCA1Calb1-环路可导致焦虑,而激活pBLA-vCA1Calb1+环路则起到抗焦虑的作用。通过联合光遗传学技术和在体钙成像技术,研究团队进一步揭示了pBLA-vCA1Calb1+环路是通过决策趋向行为而发挥抗焦虑作用的。
参考文献:
1. Krypotos AM, Effting M, Kindt M, Beckers T. Avoidance learning: a review of theoretical models and recent developments. Frontiers in behavioral neuroscience 9, 189 (2015).
2. Ciocchi S, et al. Encoding of conditioned fear in central amygdala inhibitory circuits. Nature 468, 277-282 (2010).
3. Davidson RJ. Anxiety and affective style: role of prefrontal cortex and amygdala. Biological psychiatry 51, 68-80 (2002).
4. Tye KM, et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature 471, 358-362 (2011).
5. Richardson MP, Strange BA, Dolan RJ. Encoding of emotional memories depends on amygdala and hippocampus and their interactions. Nature neuroscience 7, 278-285 (2004).
如有相关实验需求,或了解更多产品服务,欢迎咨询我们!