武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
腺相关病毒载体在心脏中的研究及应用
2400 人阅读发布时间:2023-08-04 11:24
一、原理
腺相关病毒(Adeno-associated Virus,AAV)属于细小病毒科(parvoviridae),病毒颗粒无包膜,结构为直径约20nm的正二十面体,是迄今发现的一类结构最简单且无法自主复制的线性单链DNA病毒,对分裂细胞和非分裂细胞均具有感染力。通过人工进化的方法对AAV衣壳蛋白Cap基因进行定向突变改造,可以筛选到具有高转导效率和不同感染特性的AAV载体,极大增加了AAV的应用潜力。
研究中采用的重组腺相关病毒(Recombination adeno-associated virus,rAAV)载体是在非致病的野生型AAV的基础上改造的基因表达载体,具有种类多样、免疫原性低、安全性高、宿主范围广、扩散能力强、体内表达外源基因时间长等特点,已被广泛的应用在动物水平的基因表达、基因操作和基因治疗。
研究表明AAV1、AAV6、AAV8和AAV9等对心肌细胞具有较高的趋向性,可直接静脉注射感染,不需要复杂危险的开胸手术。现有的Ⅱ期临床试验,均使用AAV。利用AAV载体可实现心脏细胞广泛表达,还可以结合特异性启动子实现细胞类型的特异性表达,如需目的基因在心肌细胞中特异性表达,可使用特异性启动子,如心肌细胞特异性启动子cT.nT、心肌细胞早期特异性启动子mNkx2.5。
rAAV所包含的DNA一般是用外源基因表达元件替换AAV的编码基因,仅保留了病毒复制和包装所需的ITR序列。通过反式补偿Rep基因、Cap基因和辅助病毒功能因子包装产生携带外源DNA的rAAV。rAAV的载体容量是4.7kb,插入外源目的片段大小不超过2.8kb。
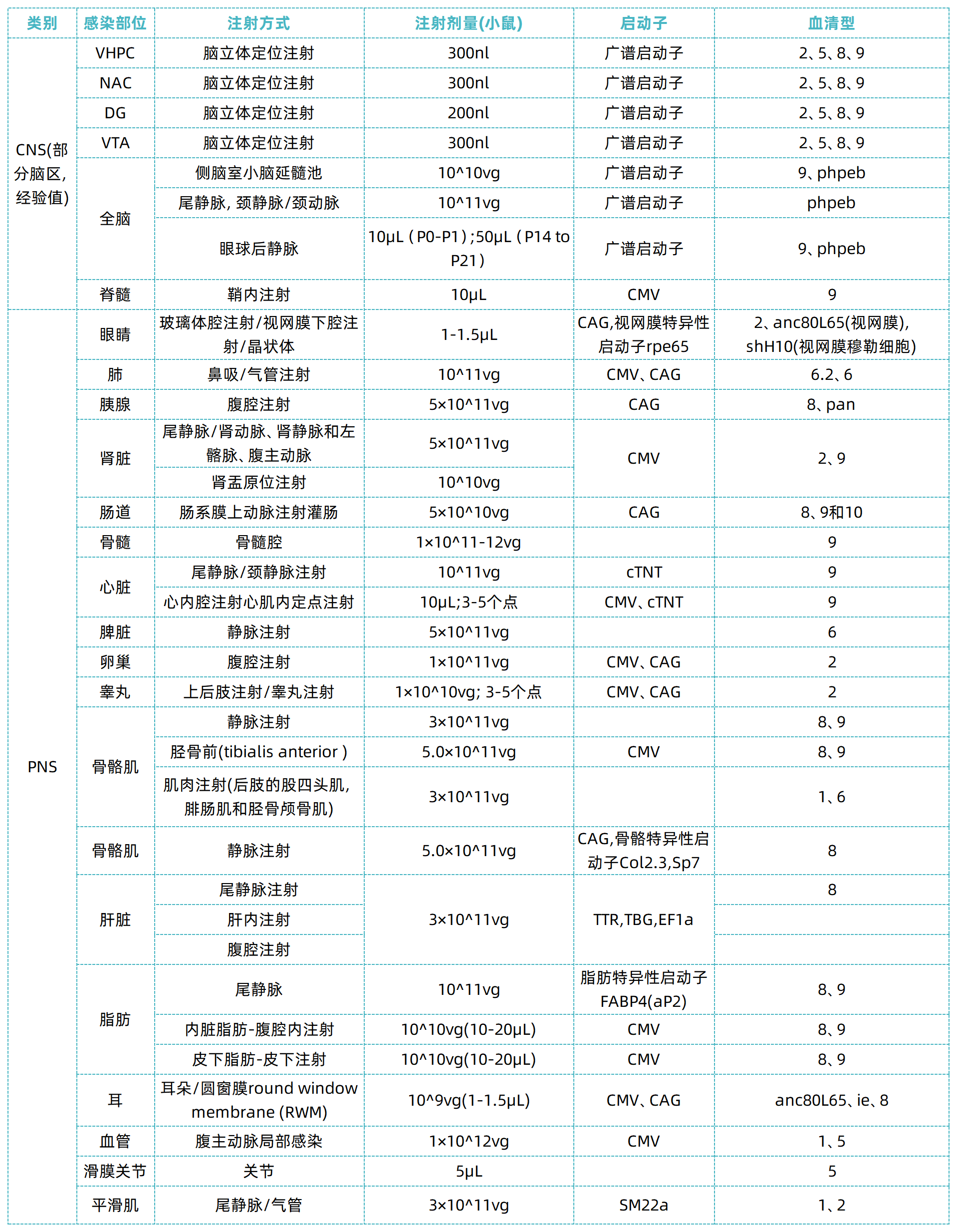
备注:
1.血清型:同一位置选择不同注射方式,所适用的血清型会存在差异;
2.注射量:不同文献,病毒供应商不同,滴度不同,剂量会有差异;
3.以上数据大多查阅文献所得,仅供参考。
二、注射方法
总体上包括静脉注射、心腔内注射、心肌内定(多)点注射、心包内注射(介于心肌与心包膜之间),其中静脉注射包括尾静脉注射、颈静脉注射、面部静脉注射等。最常用的方法是心肌定点注射和尾静脉注射。
注意事项:
1)心腔内注射需要结合主动脉嵌夹进行,由于开胸腔手术需要辅助呼吸,对手术操作要求较高。注射体积约为20μL左右。
2)心肌内定点注射时,使用27-29G的针头,每点注射约2-5μL,注意缓慢注射,病毒在注射的局部点附近感染较好,扩散有限。并且心脏定点注射需要开胸并辅助呼吸,对手术操作要求较高,也需要花费更长的操作时间。
3)由于心脏血流快,或者由于病毒进入血液系统以后,肝脏的首过效应,使尾静脉注射的病毒不容易富集在心脏(反而在肝脏的富集程度更高),因此相比其他器官,尾静脉注射需要更高的病毒量。
三、应用案例
1)

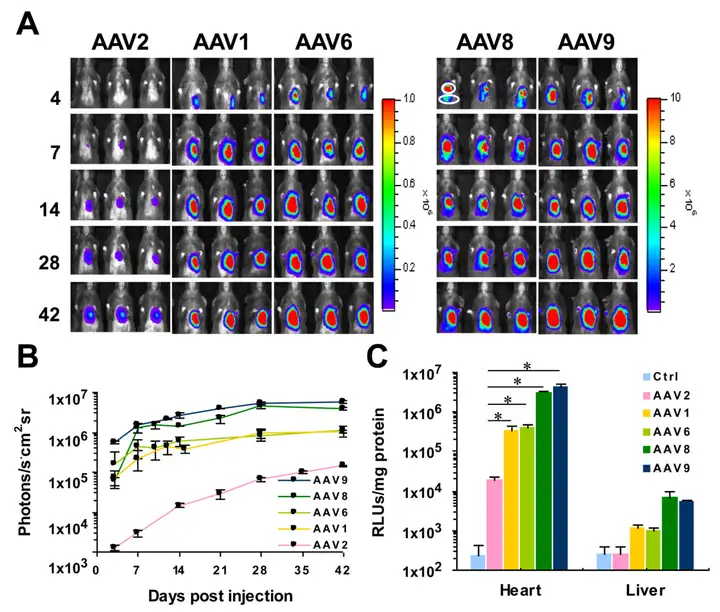
左心室前壁单次注射cT.nT启动表达Luc的5种血清型AAV载体。活体成像及荧光素酶活性测定实验显示AAV9组心脏荧光素酶活性最高。表明AAV9是目前最有效的用于直接注射转导成年小鼠心脏的血清型。
参考文献:
Prasad KM, Smith RS, Xu Y, French BA. J Gene Med. 2011.
2)

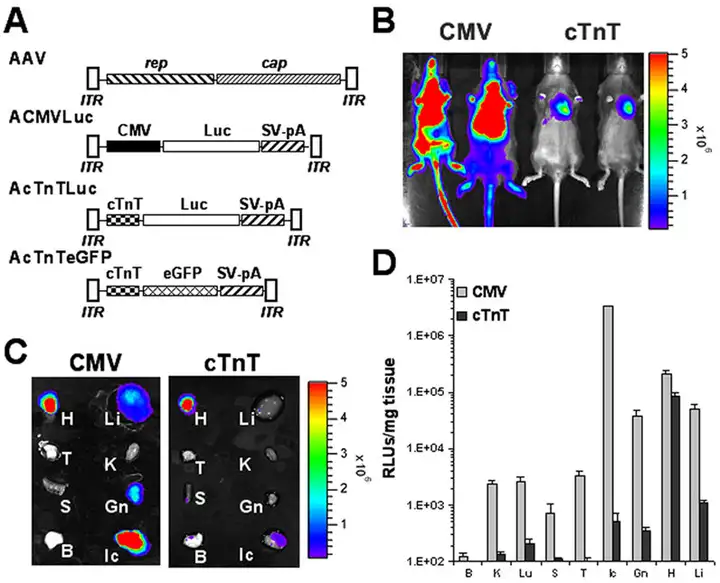
图2.测试心脏基因传递的特异启动子
活体成像显示CMV广泛表达,荧光素酶活性测定实验进一步表示cT.NT启动基因在心脏特异表达。
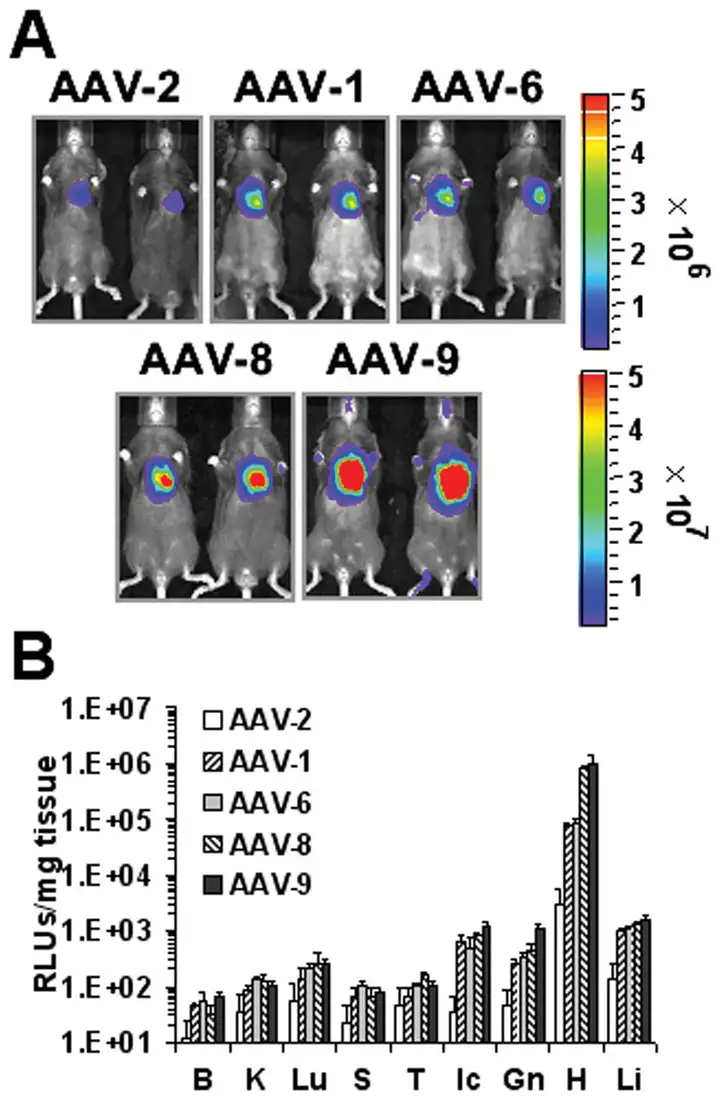
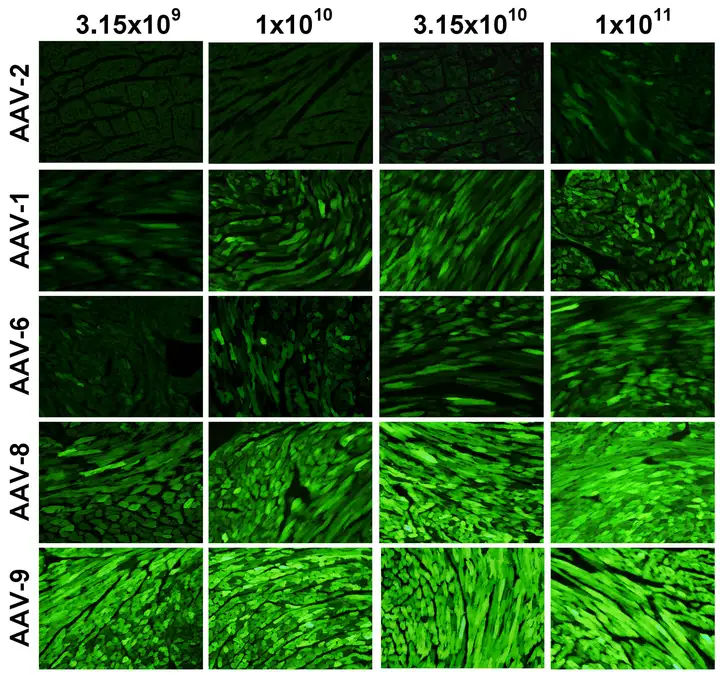
图4.5种血清型AAV载体不同注射量基因表达效果
颈静脉注射cT.nT启动表达eGFP的5种血清型AAV载体,4周后心脏冰冻切片荧光检测显示AAV9 1×1011vg病毒量时eGFP在心肌细胞表达最强。
参考文献:
Prasad KM, Xu Y, Yang Z,et al. Gene Ther. 2011.
3)用于绘制小鼠心脏解剖和生理的AAV-PHP.S(眼球后静脉丛注射)
a 整个心脏:
AAV-PHP.S(CAG-NLS-GFP),注射剂量为1×1012vg,4周后取材切片观察。
结果:AAV-PHP.S比当前标准AAV9更高效靶向心脏。
b 心肌细胞
ssAAV-PHP.S:CAG-XFPs(C57BL/6J),3个病毒的混合物,每个病毒3.3×1011vg,总量是1×1012vg,11天后取材切片观察。
结果:单个心肌细胞相互之间很容易区分。
c 心神经细胞
ssAAV-PHP.S:CAG-DIO-XFPs(TRPV1-IRES-Cre小鼠),3个病毒的混合物,每个病毒1×1012vg,总量是3×1012vg,2周后取材切片观察。
d 心内神经节细胞
ssAAV-PHP.S:Ef1α-DIO-ChR2-eYFP(ChAT-IRES-Cre小鼠),注射剂量为1×1012vg,3周后取材切片观察。
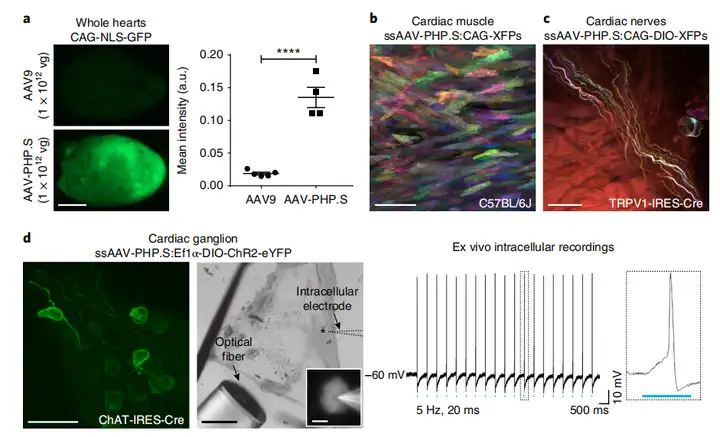
参考文献:
Challis RC, Ravindra Kumar S, Chan KY, et al. Nat Protoc. 2019.
4)心肌细胞中FXN-HA的高表达与琥珀酸脱氢酶(SDH)酶活性受损有关

5周龄时MCK小鼠静脉注射AAVRh.10-CAG-hFXN-HA载体治疗,并于12周龄处死取材切片行心脏组织学观察,高表达组AAV注射量是5×1013vg/kg,hFXN-HA的表达量是10,927ng/mg,低表达组AAV注射量是2.5×1013vg/kg,hFXN-HA的表达量是695ng/mg,5周龄时注射 NaCl的12周龄野生型(WT)小鼠以及9周龄MCK小鼠均作为对照组。结果表明高表达组心脏切片中hFXN-HA表达最强的区域但SDH酶活受损。低表达组中没发现类似现象。高表达组心脏表面SDH酶活阳性量化后是73%±2%,WT NaCl组则是83%±4%。表明不到12%的整个心脏表面被影响。
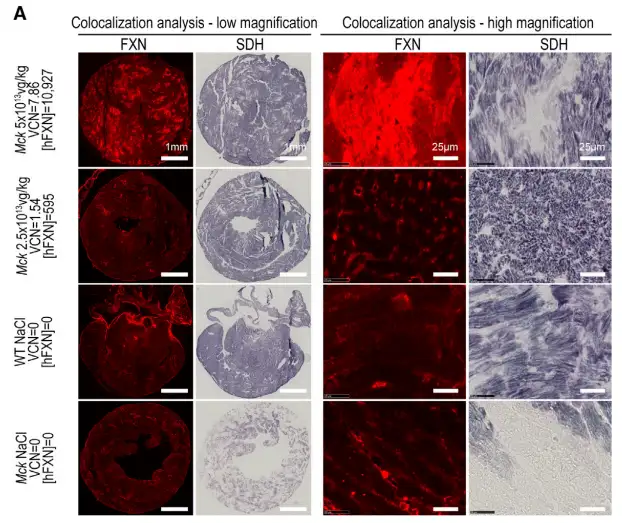
参考文献:
Belbellaa B, Reutenauer L, Messaddeq N, et al. Mol Ther Methods Clin Dev. 2020.
5) rAAV在心脏疾病例如心力衰竭和心肌梗死治疗中的应用

在医学领域,心力衰竭是一种难治疗的高发病率和高死亡率的疾病,而通过基因治疗来加强心肌收缩力,给晚期心力衰竭病人带来了希望。rAAV介导的肌浆网钙ATP酶2a(SERCA2a)基因疗法在临床上已经取得了较好的效果,Lyon AR等在大鼠构建心肌梗死(MI)后慢性心力衰竭(HF)模型,至少梗死16周后大鼠尾静脉注射总量为2× 1011 drp(DRP:DNase resistant particles的缩写。表示能抵抗DNase1消化的病毒颗粒数)的300μL AAV9.SERCA2a,注射后4-6周取材。慢性梗死大鼠心脏心室中段10μm切片H&E染色显示梗死面积大。Western blot检测结果显示经AAV9.SERCA2a感染的HF大鼠,能够恢复心肌SERCA2a和肌集钙蛋白(CSQ)表达水平。对左心室Emax(左心室17节段最大位移)、能量效率、舒张末期P(压力)V(容积)关系(EDPVR)和左心室舒张末期压力(LVEDP)进行测量发现,HF大鼠通过SERCA2a基因传递能提高Emax,降低EDPVR、LVEDP,改善心肌能量学,表明SERCA2a基因传递至衰竭心肌细胞可降低基底Ca2+水平,并以能量有利的方式启动反向重塑,从而改善左心室功能,达到治疗心力衰竭的效果。
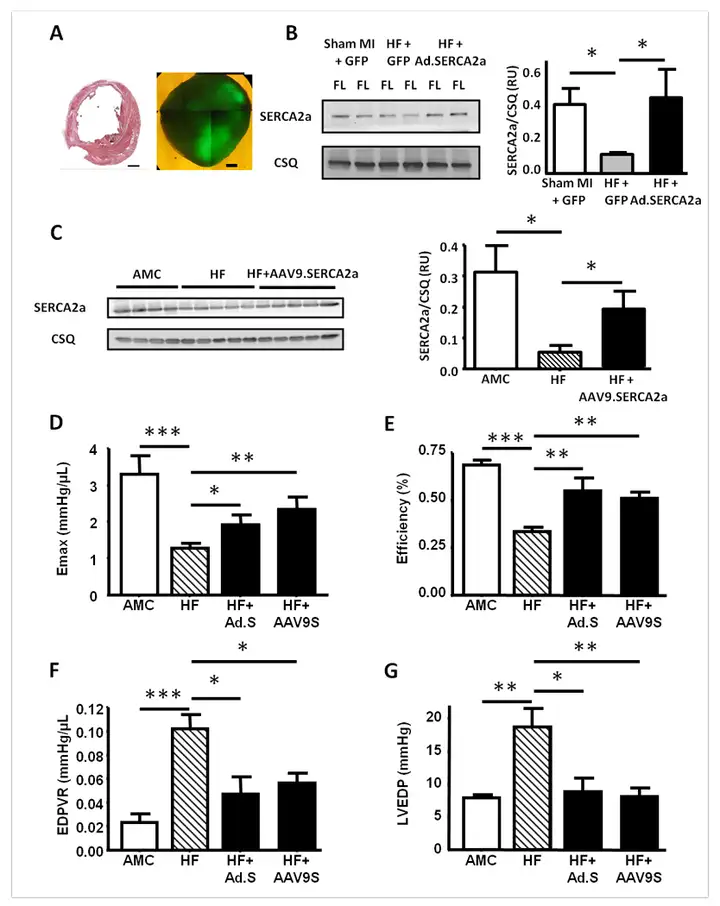
图1.基因传递SERCA2a能改善HF大鼠左心室功能
参考文献:
Lyon AR, Bannister ML, Collins T, et al. Circ Arrhythm Electrophysiol. 2011.
6)

C57BL/6J未损伤小鼠尾静脉注射100μL生理盐水溶解的3.0×1011GC rAAV9-CMV-Wnt11,2周后Western blot检测Wnt11蛋白表达。结果显示AAV9可以介导Wnt11实现心脏高水平蛋白表达。

图2.Wnt11在心脏中蛋白表达水平
手术诱导MI前的1周,接受GFP表达小鼠骨髓移植的野生型(WT)小鼠尾静脉注射3.0×1011GC编码Wnt11(rAAV9-CMV-Wnt11)或LacZ(rAAV9-CMV-LacZ)的rAAV9载体,MI8周后监测存活率。通过结扎LAD(左前降支)冠状动脉的近端部位诱发心肌梗死,从而诱发更大的梗死,通常导致相对较高的死亡率。然而,所有注射rAAV9-Wnt11的小鼠存活到第8周处死时,同一时间内内40%以上rAAV9-LacZ处理的小鼠死亡。尸检发现死亡小鼠有胸腔积液的证据,表明死亡原因是心力衰竭。
为了确定rAAV9-Wnt11治疗是否能增强缺血性损伤后的心功能,损伤前超声心动图评估左室射血分数(LVEF)、左心室舒张末期容积(LVEDV)、每搏输出量(SV),并于心肌梗死后存活小鼠第1天和第2、4、8周重复评估。在所有每周时间点,注射rAAV9-Wnt11的小鼠LVEF、SV显著高于注射rAAV9-LacZ的小鼠,这些显著差异不能归因于rAAV9-LacZ处理组的死亡率,因为存活的rAAV9-LacZ处理小鼠在第2周和第4周的LVEF和SV均值高于随后死亡小鼠。另一方面,Wnt11的表达并没有显著改变LVEDV和左心室收缩末期容积(LVESV)。
Wnt11基因表达对梗死面积的潜在影响通过存活至第8周的小鼠心脏切片天狼星红染色测量纤维化程度来评估。rAAV9-Wnt11治疗小鼠明显比rAAV9-LacZ处理小鼠纤维化范围小,但是两组之间差异没有达到统计学意义。然而,在非梗死区域rAAV9-Wnt11治疗后纤维化和血管周围纤维化明显低于rAAV9-LacZ处理后。因此,相当一部分与心肌恢复期间Wnt11基因表达相关的益处可归因于心脏非梗死区的改善。
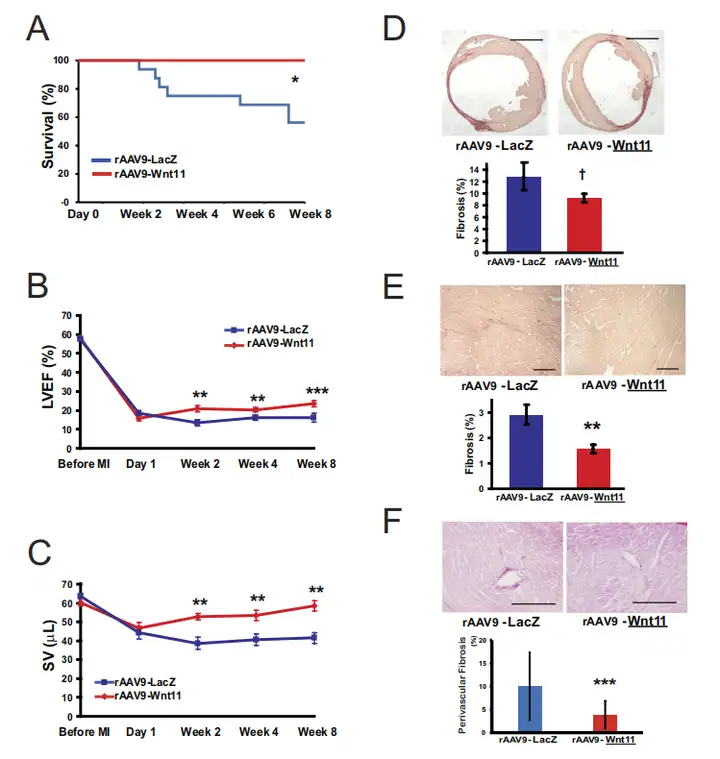
参考文献:
Morishita Y, Kobayashi K, Klyachko E, et al. Sci Rep. 2016.
7) rAAV在心脏疾病中介导的基因编辑

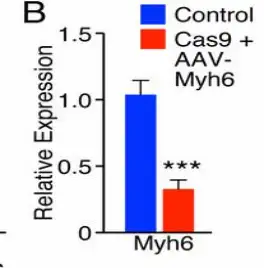
Carroll KJ等构建了带有eSpCas9(1.1)的心脏特异性转基因小鼠,通过Myh6基因的启动子(α-MHC)驱动Cas9在心肌的特异性表达。α-MHC启动子是心脏特异性转基因小鼠常用启动子。这个工具小鼠能够解决实验过程中Cas9在心脏递送和表达的难题。转基因小鼠可以维持Cas9在心脏长期高水平的表达,而这个正是CRISPR/Cas9系统在心脏部位编辑效率不高的症结所在。Cas9转基因小鼠只需要通过AAV递送sgRNA到心脏表达即可实现编辑效率的提高。
研究中首先将U6启动子控制下靶向Myh6基因外显子3的 sgRNA与CMV驱动的ZsGreen报告基因一起克隆到AAV9骨架中,并在出生后第10天(P10)的小鼠腹腔注射1×1012vg的病毒,5-6周后进行分析。qPCR检测显示Cas9小鼠中AAV传递sgRNA后心脏Myh6表达显著下调(降低50%以上)。对编辑心脏结构观察显示,心脏极端扩张和肥大,心室壁变薄和心房和心室大量扩张。因此,这种方法成功得到同时发生心肌肥厚和扩张型心脏的突变小鼠。该方法可用于疾病建模,并能够快速编辑心脏中基因。
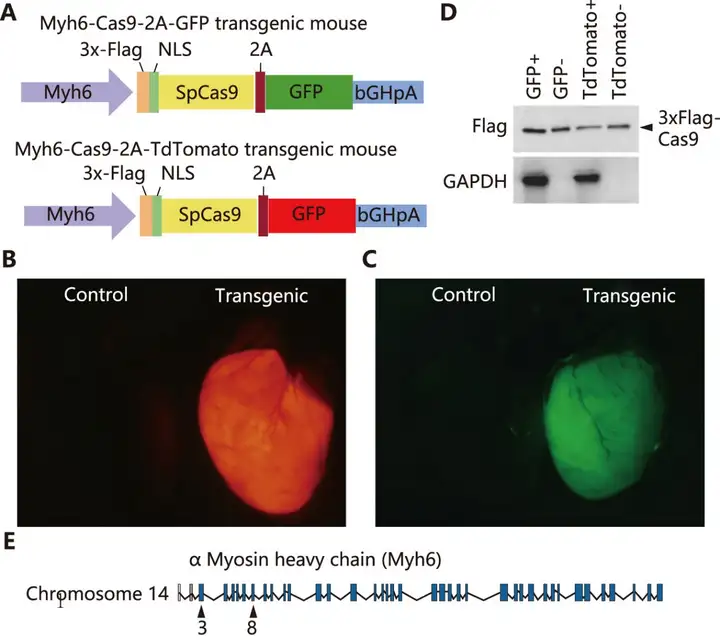
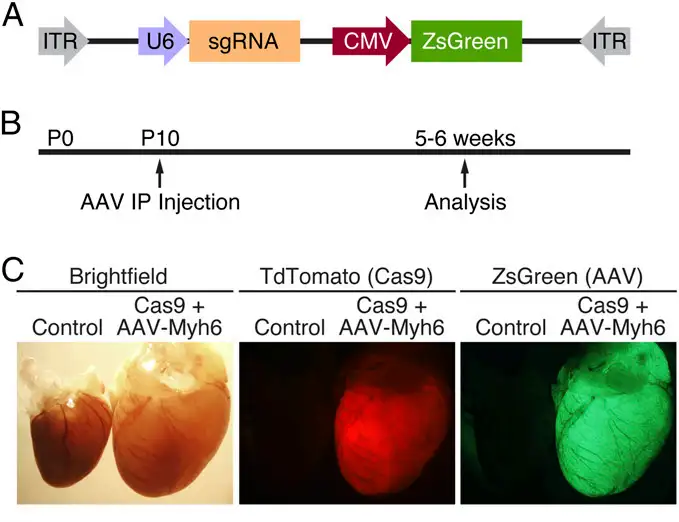
参考文献:
Carroll KJ, Makarewich CA, McAnally J, et al. Proc Natl Acad Sci U S A. 2016.
如有相关实验需求,或了解更多产品服务,欢迎咨询我们!