武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
IF=9.995【客户文章】李斐/李伟广/张孝勇/梅兵教授团队合作提出基于突触细胞生物学特征的自闭症社交障碍分型标准
720 人阅读发布时间:2023-06-12 15:04
突触作为大脑通讯的基本单元,存在兴奋性和抑制性等不同类型。突触的兴奋性/抑制性失衡被认为是自闭症等精神神经疾病的根本发病机制[2-4]。然而,自闭症多样化的社交障碍与特定类型突触失衡之间的对应规律还不清楚。在本研究中,研究团队聚焦小G蛋白Rac1这一突触骨架调节因子[5, 6],致力于阐明Rac1活性失调引起社交障碍的突触细胞生物学机制。Rac1是一类核苷酸依赖型的分子开关,在与GTP结合的活化状态和与GDP结合的非活化状态之间进行相互转换,参与肌动蛋白动力学调控和突触重塑。临床证据表明,人群中RAC1功能获得型或缺失型基因突变均与自闭症密切相关[7]。动物模型研究表明,脆性X综合征(Fmr1基因敲除小鼠,Fmr1 KO)[8]、Shank3基因C末端缺失(Shank3+/ΔC)[9]等自闭症小鼠模型分别表现出Rac1活性上调或下调。然而,Rac1活性失调(上调或下调还是两者均可)是否以及如何导致社交障碍,而且是否依赖于细胞特异性的调控作用仍不清楚。
2022年11月29日,上海交通大学医学院附属新华医院李斐教授团队、复旦大学李伟广教授团队和张孝勇青年研究员团队、华东师范大学梅兵研究员团队等合作在Cell Press细胞出版社期刊Cell Reports上在线发表题为“Social deficits via dysregulated Rac1-dependent excitability control of prefrontal cortical neurons and increased GABA/glutamate ratios”的研究论文[10]。华东师范大学马冰珂博士为论文的第一作者。该研究综合运用自闭症小鼠模型、行为学、小动物核磁共振波谱成像、光遗传学、化学遗传学、电生理、分子遗传学、细胞生物学等多种技术手段,面向自闭症社交障碍在病因学、行为表现方面的异质性和复杂性这一临床难题,通过解析大脑内侧前额叶皮层(mPFC)不同类型细胞上突触骨架调节蛋白(Rac1)活性双向改变引起的神经元兴奋性和特定神经递质含量变化及其与异常社交行为的精确对应关系,提出了基于突触细胞生物学特征的自闭症社交障碍分型标准,为理解自闭症社交障碍的共性病理机制、发展病因学指导下的疾病诊断和治疗新策略提供了重要的理论依据。

为明确Rac1活性改变与社交障碍之间的因果关系,研究团队利用病毒立体定位注射技术结合动物行为学实验发现,在社交行为关键脑区——mPFC[11-13]双向操纵Rac1活性均导致小鼠社交能力下降。进一步利用小动物核磁共振波谱(MRS)技术测量神经递质[14]发现,Rac1活性上调导致谷氨酸递质含量降低,不影响GABA递质;Rac1活性下调不影响谷氨酸递质,增加GABA含量。二者最终均导致mPFC抑制性/兴奋性比值失衡性增高(图1)。以上结果提示,mPFC神经元Rac1活性的双向调控导致社交能力受损,与mPFC的兴奋性/抑制性失衡有关。
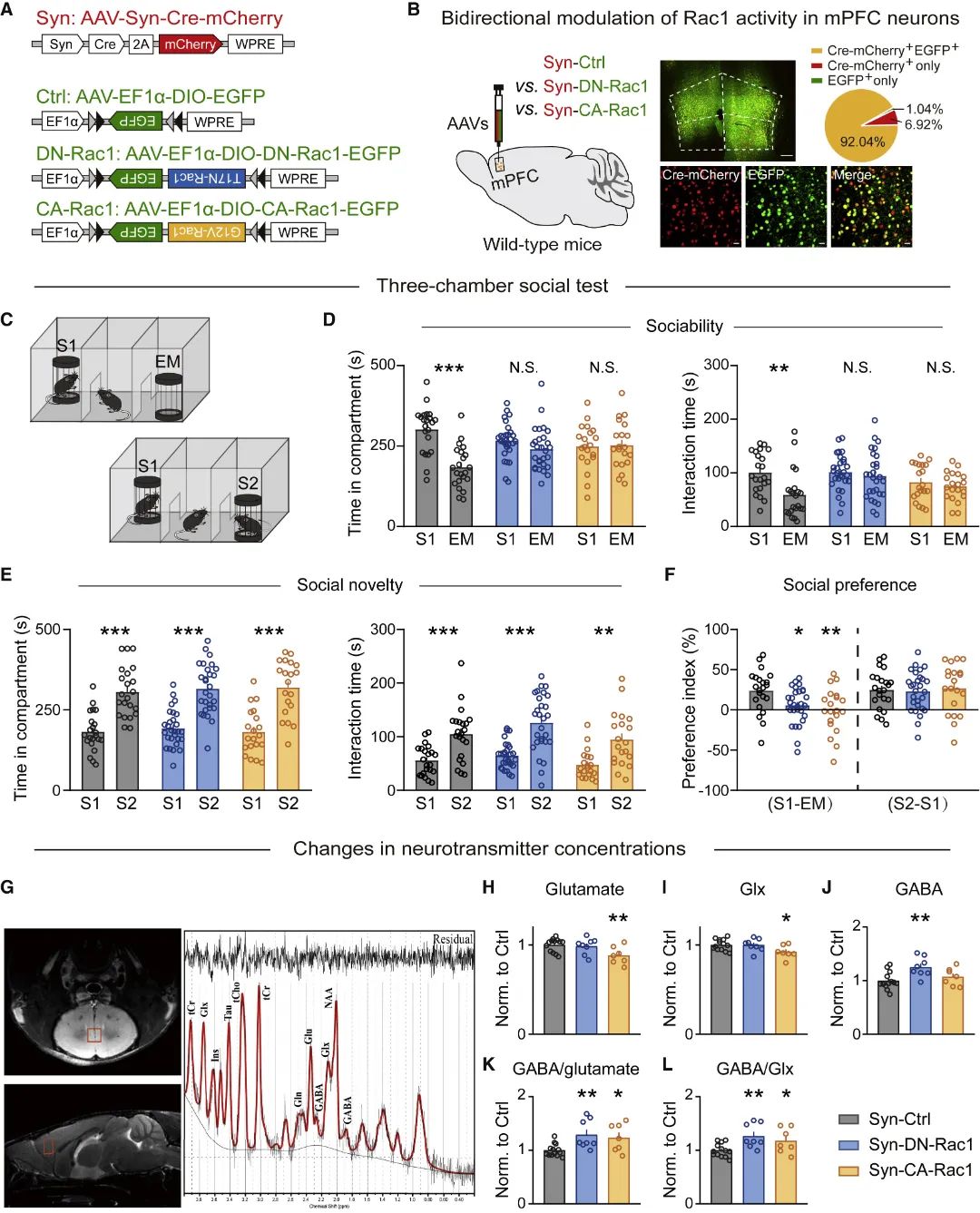
(图源:Ma, et al., Cell Rep, 2022)
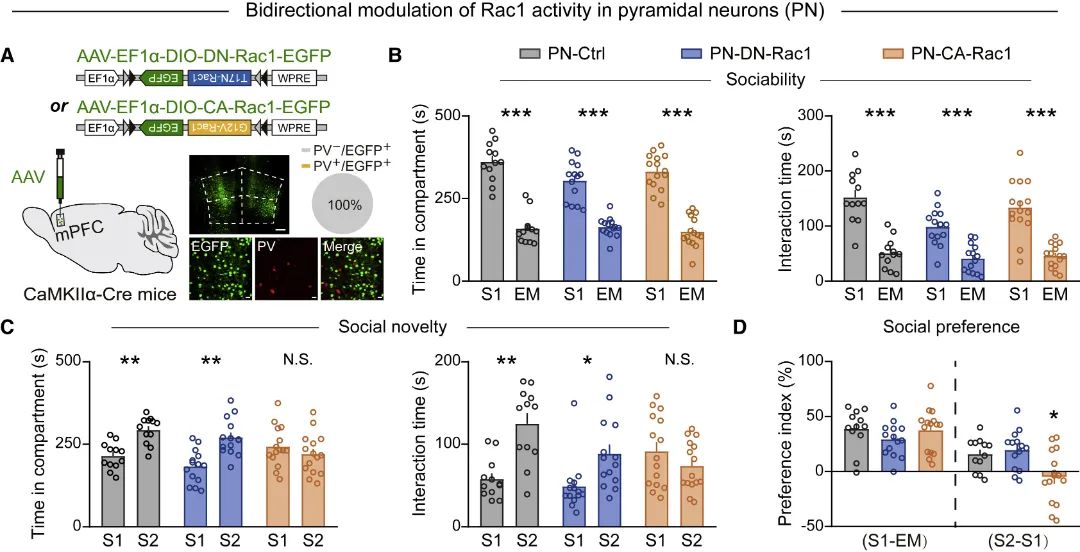
mPFC脑区由不同神经元类型组成,包括兴奋性谷氨酸能神经元和抑制性GABA能中间神经元等。为研究不同细胞类型中Rac1活性改变如何参与社交障碍,研究团队进行了细胞类型特异的Rac1活性操纵发现,兴奋性神经元Rac1活性上调导致小鼠社交新颖性测试(反映社交记忆)功能受损,下调不影响社交行为(图2)。通过MRS和电生理进一步探究其细胞特异性调控机制发现,兴奋性神经元Rac1活性上调导致谷氨酸能神经元兴奋性和谷氨酸含量降低,通过化学遗传或光遗传激活谷氨酸能神经元可解救兴奋性神经元Rac1活性上调导致的社交障碍(图3)。
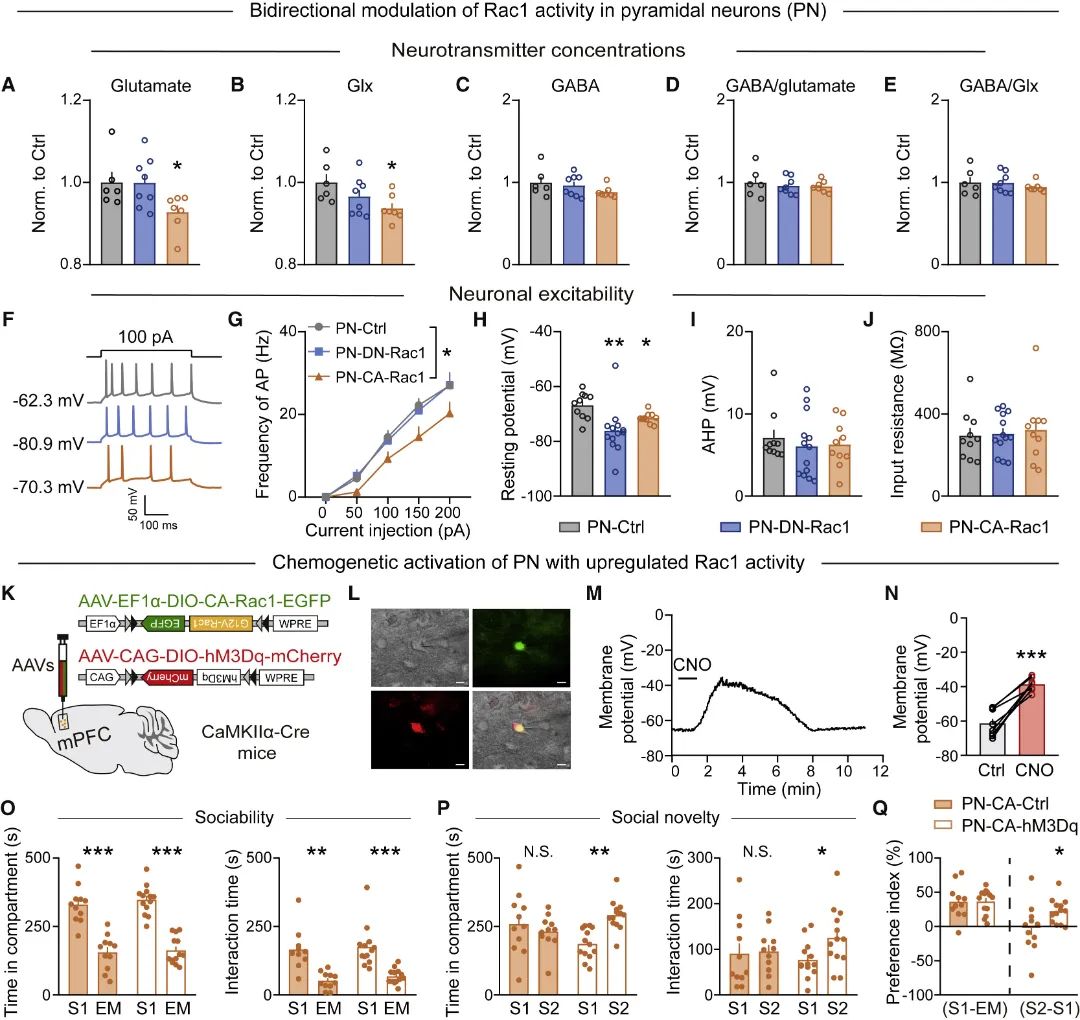
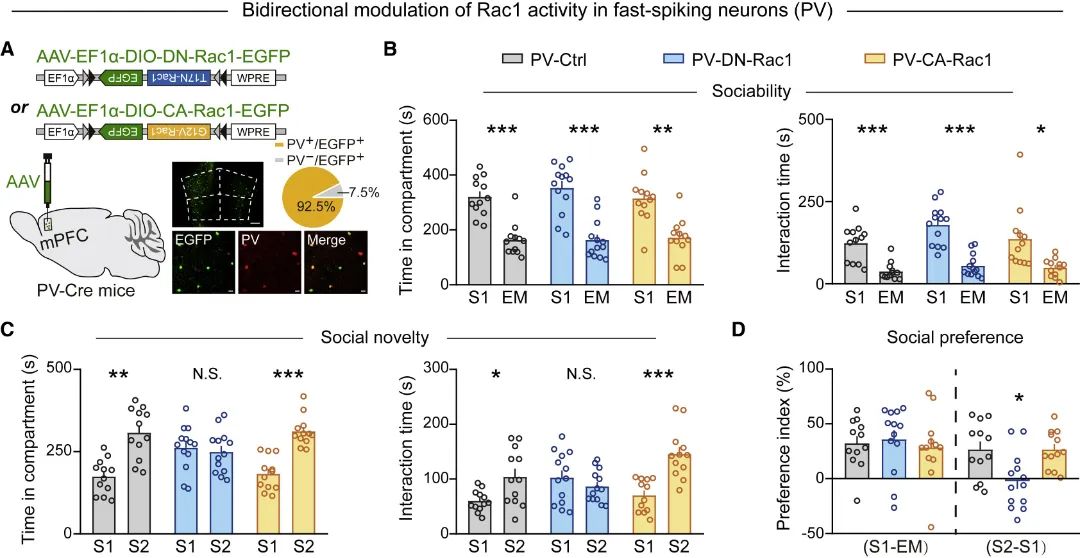
图4 mPFC的PV神经元Rac1活性双向调控对社交行为的影响(图源:Ma, et al., Cell Rep, 2022)
为进一步完善细胞特异性调控机制,研究团队采用与兴奋性神经元类似的策略,双向调控小清蛋白(PV)阳性的抑制性中间神经元的Rac1活性发现,PV神经元Rac1活性下调导致小鼠社交新颖性识别能力受损,上调不影响社交行为(图4)。此外,PV神经元Rac1活性下调增加GABA含量和PV神经元兴奋性,通过化学遗传失活PV神经元可解救PV神经元Rac1活性下调导致的社交障碍(图5)。该结果表明,mPFC不同类型神经元对Rac1活性双向改变存在不同适应性。
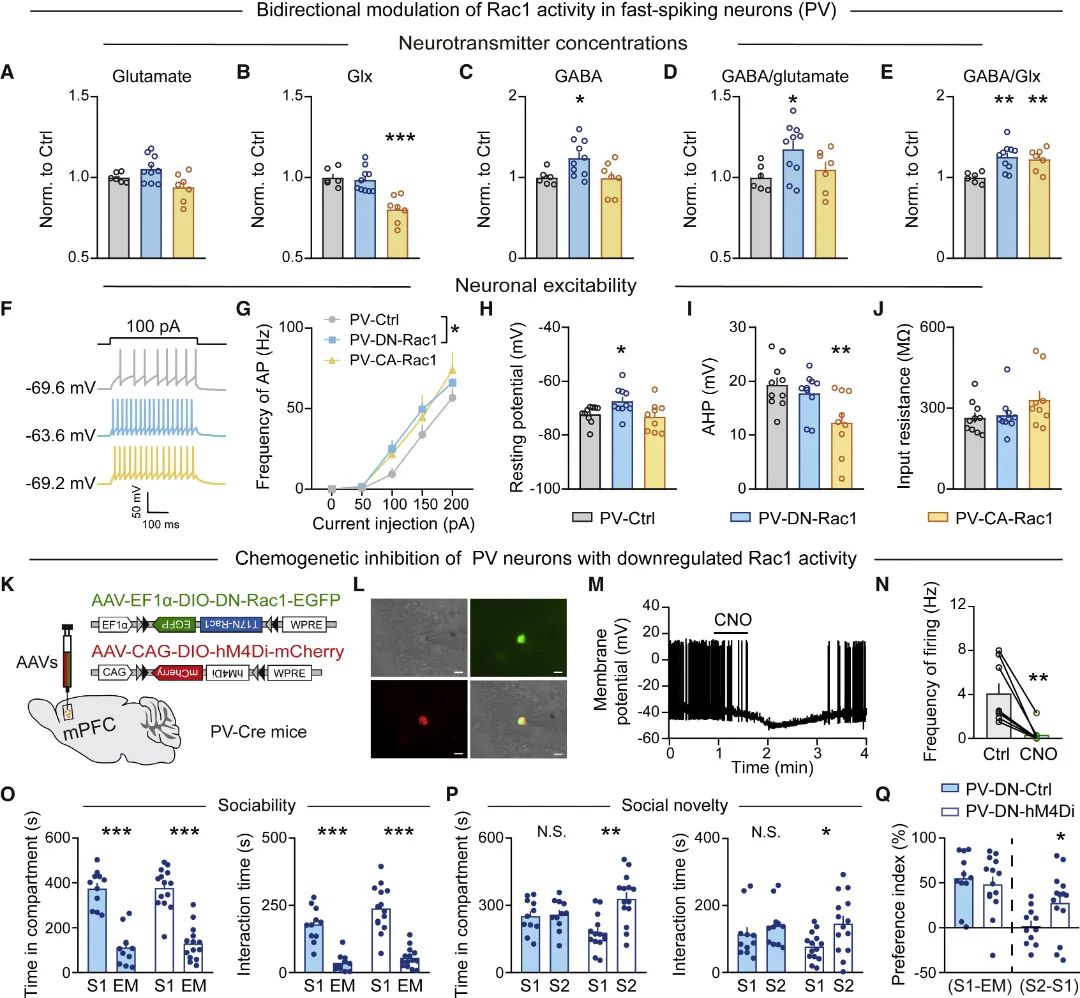
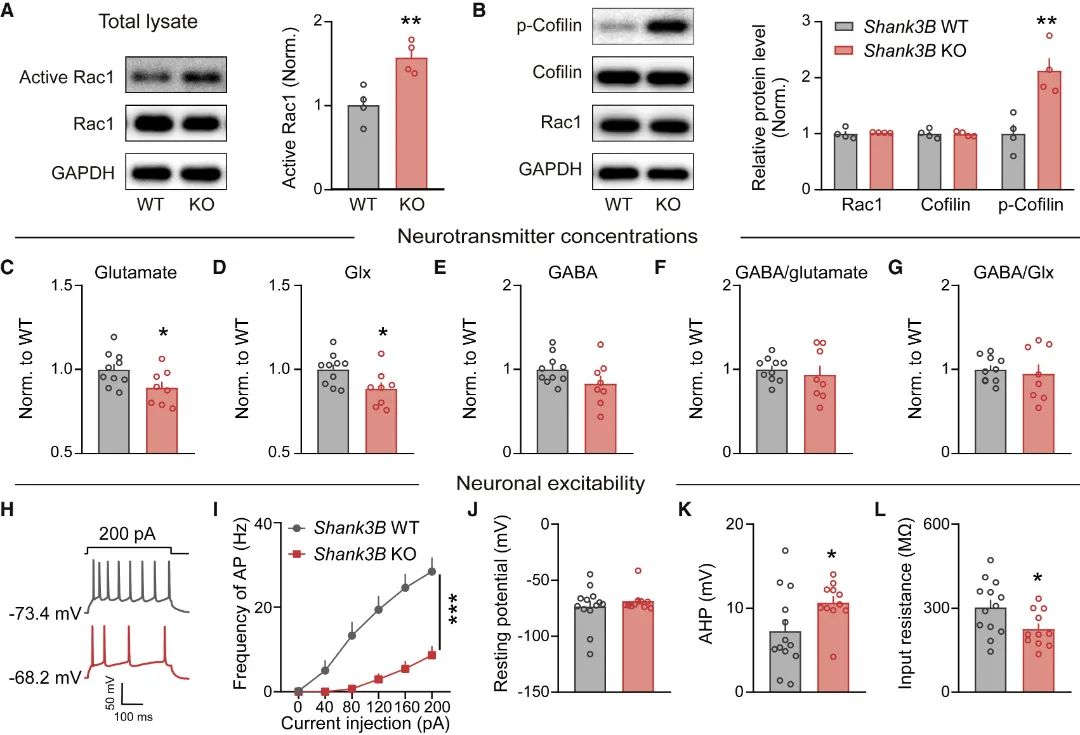
接着,研究团队选择一种区别于Shank3+/ΔC(缺失Shank3基因C末端)的自闭症模型小鼠Shank3B KO(缺失Shank3基因PDZ结构域)[15]进行测试发现,Shank3B KO小鼠在行为上表现出社交记忆功能受损,同时其mPFC区Rac1活性升高,谷氨酸能神经元兴奋性和谷氨酸递质含量均降低(图6)。为此,研究团队在Shank3B KO小鼠mPFC谷氨酸能神经元选择性地进行Rac1活性抑制或神经元兴奋性上调干预,发现均能明显改善该自闭症模型小鼠的社交障碍(图7)。
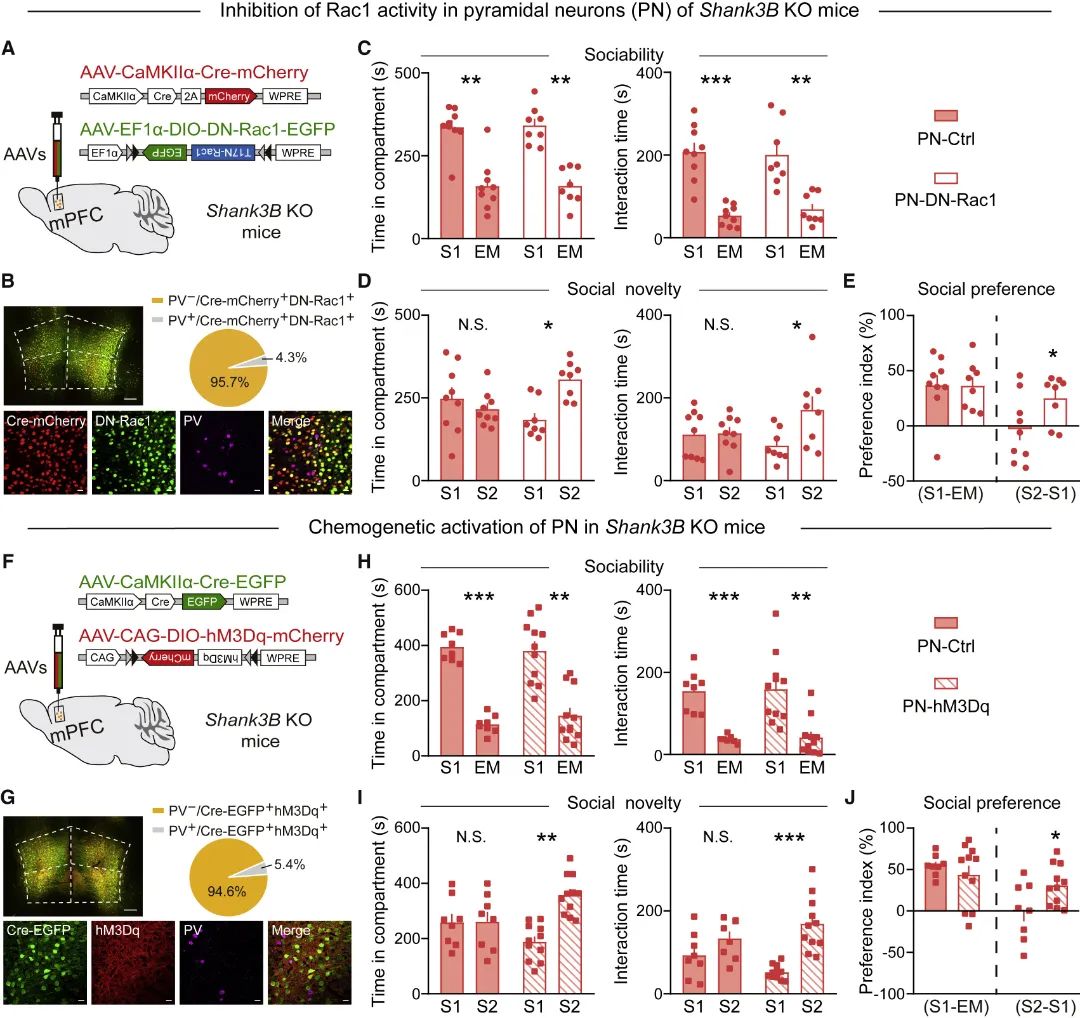
图7 自闭症模型Shank3B KO小鼠社交障碍的细胞特异性纠正策略(图源:Ma, et al., Cell Rep, 2022)
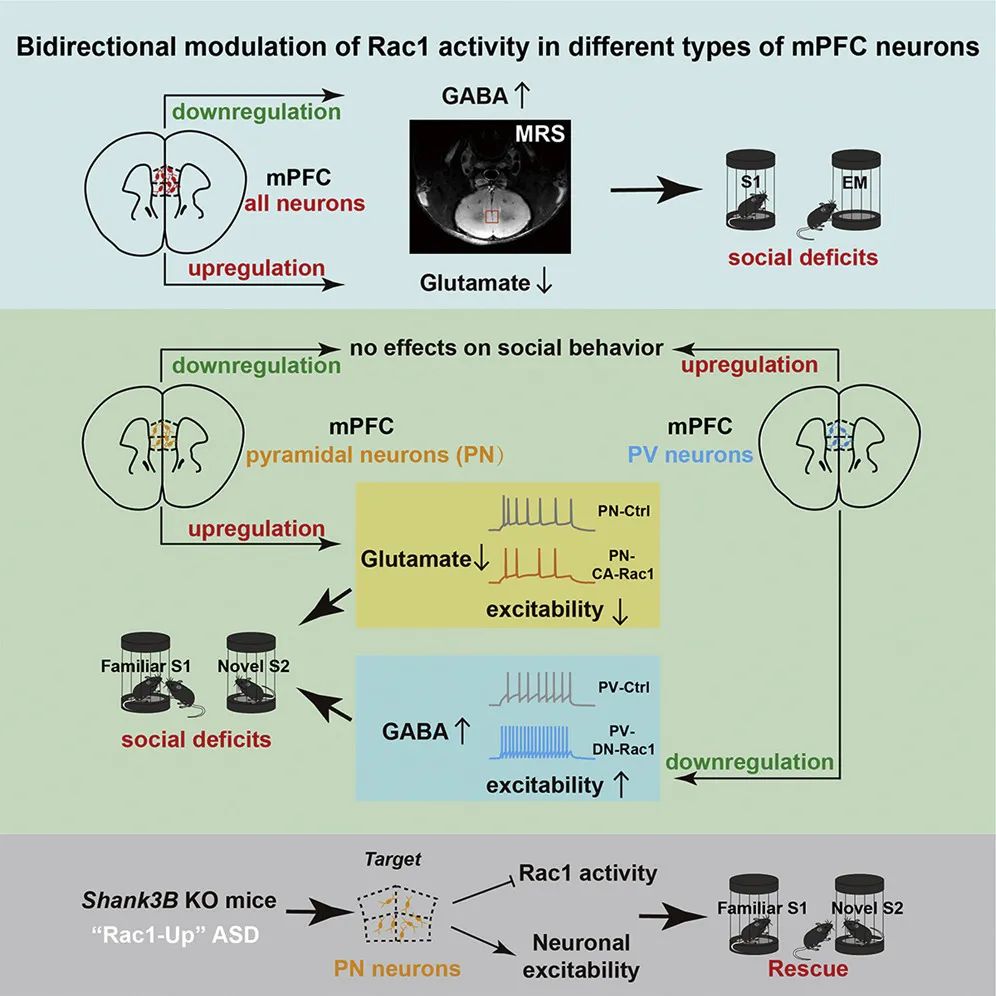
图8 工作总结图:mPFC不同类型神经元Rac1活性的双向改变导致社交障碍的示意图(图源:Ma, et al., Cell Rep, 2022)
文章结论与讨论,启发与展望
根据上述发现,研究团队提出了一种基于突触细胞生物学特征的社交障碍分型标准,即分为“Rac1上调型”(Rac1-up,主要累及谷氨酸能神经元,表现为谷氨酸递质含量降低)和“Rac1下调型”(Rac1-down,主要累及抑制性中间神经元,表现为GABA递质含量升高),二者均导致mPFC抑制性/兴奋性比值失衡性增高。在自闭症模型上,Shank3B KO小鼠mPFC中Rac1活性升高,谷氨酸能神经元兴奋性降低,谷氨酸递质含量降低,因此被归为“Rac1上调型”社交障碍。对于Fmr1 KO自闭症小鼠模型,根据文献报道[8],其Rac1活性上调,推测可能也属于“Rac1上调型”社交障碍。但是,对于Shank3+/ΔC自闭症小鼠模型,根据文献[9]报道,其Rac1活性下调,或许适用于“Rac1下调型”社交障碍,有待在未来研究中进一步测试。总之,该研究从突触细胞生物学的角度,建立了mPFC神经元Rac1活性异常以细胞类型特异的方式调节神经元兴奋性和突触抑制性/兴奋性比值失衡进而导致社交障碍的工作模型(图8),揭示了Rac1活性双向改变引致不同类型社交障碍的融合生物学机制。该研究使得自闭症社交障碍的分型成为可能,为发展生物学机制指导下的社交障碍干预新策略奠定了理论基础。
这里的发现只是动物模型的研究,未来还需要在人群中进行小心测试。基于该研究,在未来临床实践中,或许可以根据社交障碍相关的综合行为分析,同时结合通过核磁共振波谱技术测量特定脑区(包括mPFC)的GABA/谷氨酸比值和各自的递质浓度,有望发展出一套精准评价自闭症社交障碍的新型诊疗工具。
值得指出的是,在该研究的细胞特异性调控中,Rac1的生物学效应整体上是一致的,即都是抑制“调控响应神经元”的活性。然而,研究人员对于Rac1抑制性调控神经元兴奋性的分子机制仍缺乏系统认识,推测神经元的突触传递或内在兴奋性(比如不同类型膜离子通道的差异表达)可能都会受到影响。其中,Rac1活性调控的细胞类型特异性可能具有极为特殊的重要意义。
基于Rac1在细胞生物学中的核心地位,研究人员推测,多种增加自闭症患病可能性的遗传或环境因素,可能在特定脑区、特定细胞类型上通过Rac1依赖的细胞生物学机制,最终产生突触失衡并贡献于疾病症状。基于该研究揭示的从Rac1活性失调到突触失衡和社交障碍的基本规律,研究人员设想在肿瘤或其他系统研究中开发获得的Rac1信号通路调节剂[16]、改变突触兴奋-抑制失衡老药(如强效环形利尿剂布美他尼)[17]都有望成为精准治疗自闭症社交障碍的备选方案。
通讯作者简介

李伟广,复旦大学脑科学转化研究院研究员,博士生导师,附属华山医院双聘教授。上海市优秀学术带头人计划(青年)、上海市卫生健康学科带头人、上海市青年科技启明星计划、上海市青年拔尖人才开发计划、中国科协青年人才托举工程等人才支持计划获得者。致力于记忆原理及医学应用研究,解析情绪、摄食、运动等正常生命活动过程中包含的“记忆”内容及其痕迹生物学基础;以记忆的视角审视慢性神经精神疾病的症状演变和康复;探索外周或中枢规律性刺激使大脑活性发生“记忆”样长程改变的新模式及其可塑性机理,发展基于记忆原理的疾病干预新策略,推进临床转化应用。以通讯或第一作者(含共同)在Neuron、Molecular Psychiatry、Nature Communications、Science Advances、Cell Reports、National Science Review、Signal Transduction and Targeted Therapy等学术期刊发表论文三十余篇。
张孝勇,复旦大学类脑智能科学与技术研究院青年研究员,中国图象图形学会脑图谱专委会委员,中华放射学会国际交流工作组委员,MICS委员。主要从事磁共振成像和脑影像的人工智能分析研究,在磁共振代谢成像方向做出了若干原创性贡献。以通讯作者/第一作者发表学术论文30余篇,代表性成果发表在IEEE Transactions on Medical Imaging、Advanced Science、Cancer Research等期刊。研究成果曾被国际医学磁共振学会(ISMRM)官网以研究亮点报道。作为课题负责人主持多项国家自然科学基金项目及上海市项目,并以研究骨干参与国家自然科学基金重大项目、集成项目等。
参考文献
1.Lord C, Brugha TS, Charman T, Cusack J, Dumas G, Frazier T, Jones EJH, Jones RM, Pickles A, State MW, Taylor JL, Veenstra-VanderWeele J. Autism spectrum disorder. Nat Rev Dis Primers. 2020; 6(1): 5.
2.Lima Caldeira G, Peça J, Carvalho AL. New insights on synaptic dysfunction in neuropsychiatric disorders. Curr Opin Neurobiol. 2019; 57: 62-70.
3.Bourgeron T. From the genetic architecture to synaptic plasticity in autism spectrum disorder. Nat Rev Neurosci. 2015; 16(9): 551-63.
4.Bagni C, Zukin RS. A synaptic perspective of Fragile X Syndrome and autism spectrum disorders. Neuron. 2019; 101(6): 1070-88.
5.Tejada-Simon MV. Modulation of actin dynamics by Rac1 to target cognitive function. J Neurochem. 2015; 133(6): 767-79.
6.Hotulainen P, Hoogenraad CC. Actin in dendritic spines: connecting dynamics to function. J Cell Biol. 2010; 189(4): 619-29.
7.Reijnders MRF, Ansor NM, Kousi M, Yue WW, Tan PL, Clarkson K, Clayton-Smith J, Corning K, Jones JR, Lam WWK, Mancini GMS, Marcelis C, Mohammed S, Pfundt R, Roifman M, Cohn R, Chitayat D; Deciphering Developmental Disorders Study, Millard TH, Katsanis N, Brunner HG, Banka S. RAC1 Missense Mutations in Developmental Disorders with Diverse Phenotypes. Am J Hum Genet. 2017; 101(3): 466-77.
8.Pyronneau A, He Q, Hwang JY, Porch M, Contractor A, Zukin RS. Aberrant Rac1-cofilin signaling mediates defects in dendritic spines, synaptic function, and sensory perception in fragile X syndrome. Sci Signal. 2017; 10(504): eaan0852.
9.Duffney LJ, Zhong P, Wei J, Matas E, Cheng J, Qin L, Ma K, Dietz DM, Kajiwara Y, Buxbaum JD, Yan Z. Autism-like deficits in Shank3-deficient mice are rescued by targeting actin regulators. Cell Rep. 2015; 11(9): 1400-13.
10.Ma B, Shan X, Yu J, Zhu T, Li R, Lv H, Cheng H, Zhang T, Wang L, Wei F, Meng B, Yuan X, Mei B, Zhang XY, Li WG, Li F. Social deficits via dysregulated Rac1-dependent excitability control of prefrontal cortical neurons and increased GABA/glutamate ratios. Cell Rep. 2022; 41(8): 111722.
11.Yizhar O, Fenno LE, Prigge M, Schneider F, Davidson TJ, O'Shea DJ, Sohal VS, Goshen I, Finkelstein J, Paz JT, Stehfest K, Fudim R, Ramakrishnan C, Huguenard JR, Hegemann P, Deisseroth K. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature. 2011; 477(7363): 171-8.
12.Murugan M, Jang HJ, Park M, Miller EM, Cox J, Taliaferro JP, Parker NF, Bhave V, Hur H, Liang Y, Nectow AR, Pillow JW, Witten IB. Combined social and spatial coding in a descending projection from the prefrontal cortex. Cell. 2017; 171(7): 1663-77.
13.Cao W, Lin S, Xia QQ, Du YL, Yang Q, Zhang MY, Lu YQ, Xu J, Duan SM, Xia J, Feng G, Xu J, Luo JH. Gamma oscillation dysfunction in mPFC leads to social deficits in Neuroligin 3 R451C knockin mice. Neuron. 2018; 97(6): 1253-60.
14.Horder J, Petrinovic MM, Mendez MA, Bruns A, Takumi T, Spooren W, Barker GJ, Künnecke B, Murphy DG. Glutamate and GABA in autism spectrum disorder-a translational magnetic resonance spectroscopy study in man and rodent models. Transl Psychiatry. 2018; 8(1): 106.
15.Peça J, Feliciano C, Ting JT, Wang W, Wells MF, Venkatraman TN, Lascola CD, Fu Z, Feng G. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 2011; 472(7344): 437-42.
16.Cannon AC, Uribe-Alvarez C, Chernoff J. RAC1 as a therapeutic target in malignant melanoma. Trends Cancer. 2020; 6(6): 478-88.
17.Dai Y, Zhang L, Yu J, Zhou X, He H, Ji Y, Wang K, Du X, Liu X, Tang Y, Deng S, Langley C, Li WG, Zhang J, Feng J, Sahakian BJ, Luo Q, Li F. Improved symptoms following bumetanide treatment in children aged 3-6 years with autism spectrum disorder: a randomized, double-blind, placebo-controlled trial. Sci Bull. 2021; 66: 1591-8.
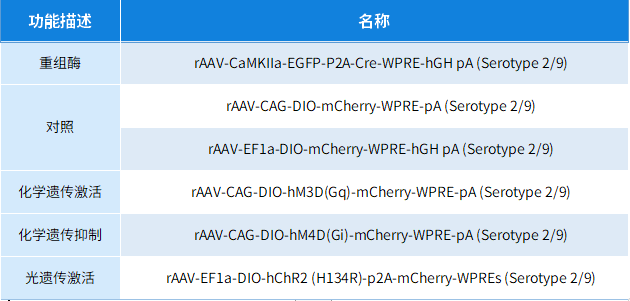
本文使用的来自枢密科技的病毒产品,列表如下:
更多产品可咨询我们!