武汉枢密脑科学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.09999999999999964
- 0.09999999999999964
- 1.0999999999999996
- 0.09999999999999964
武汉枢密脑科学技术有限公司
入驻年限:8 年
- 联系人:
枢先生
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
抗体、试剂、细胞库 / 细胞培养、技术服务、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
《文献解读》恢复神经环路连接治疗阿尔兹海默症
792 人阅读发布时间:2023-06-13 08:56
在目前的痴呆性疾病中阿尔兹海默症(Alzheimer's disease, AD)是最常见的,会导致严重的认知障碍,且目前并无有效的治疗手段。对AD患者的大脑进行分析,发现淀粉样β肽(amyloid-β peptides, Aβ)细胞外聚集、微管相关蛋白Tau和神经原纤维缠结可作为AD的病理特征,但目前并不能确定这些病例特征和AD发病进展的因果关系。
认知障碍和记忆大量丢失出现在AD晚期,这时候Aβ已经大量沉积,神经原纤维缠结已经形成,细胞也已经死亡,在此阶段治疗AD难度极大。但若能找到AD早期的病理特征,进行特异性干预,则为改善甚至治愈AD带来可能。

一、淀粉样蛋白级联假说与神经环路功能
在AD发病机制中Aβ级联假说被广泛认可,该假说认为Aβ的堆积是AD认知障碍的基础,Aβ堆积导致神经原纤维缠结,引起神经元退行性病变,从而导致记忆的丢失。Aβ是由淀粉样前体蛋白(amyloid precursor protein,APP)顺序切割产生的,APP的结构中包含淀粉样β结构域,并具有分泌酶切割位点,通过两条途径竞争APP的底物,从而产生非淀粉样蛋白和淀粉样蛋白。
在非淀粉样蛋白生成途径中,α-分泌酶切割淀粉样β结构域释放出可溶性胞外域aAPPα和C端片段CTFα,γ-分泌酶对CTFα进行后续切割产生可溶性的细胞外P3肽和APP胞内结构域AICD。而在淀粉样蛋白生成途径中,β-分泌酶切割淀粉样β结构域释放出可溶性胞外域aAPPβ和C端片段CTFβ,γ-分泌酶切割对CTFβ产生Aβ和AICD片段。
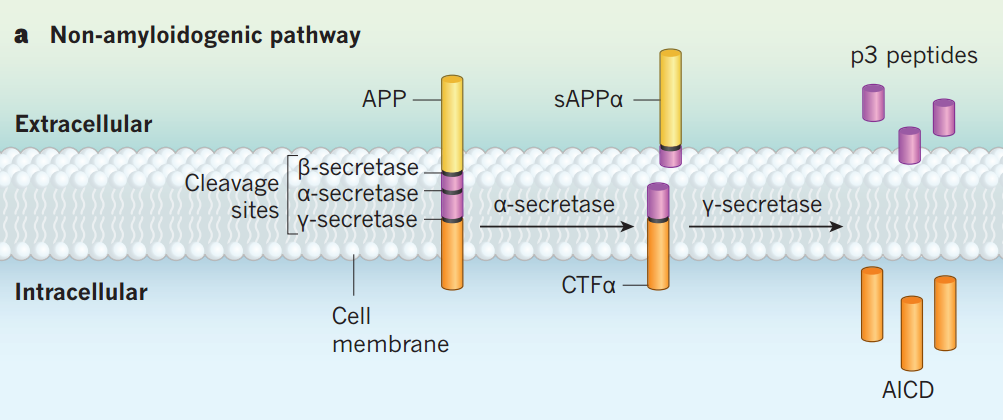
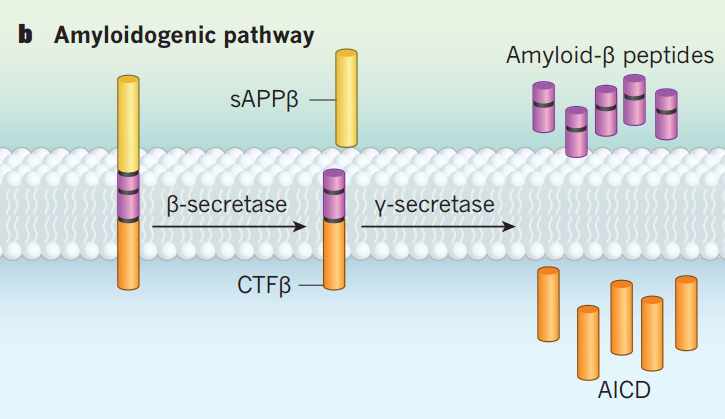
图1 Aβ的合成过程
Aβ是急性毒性肽,对神经元和其他类型的细胞有多种有害作用。Aβ通过与细胞表面受体相互作用直接诱发神经元死亡。此外Aβ的长期堆积会导致DNA和蛋白质的氧化损伤、引起细胞器功能障碍并引起细胞内钙水平异常。Aβ高表达的区域,出现突触可塑性异常、大量的突触丢失和神经环路功能障碍。因此在AD患者中,可塑性异常、突触丢失有可能早于Aβ堆积,并且突触丢失会导致环路功能障碍和认知障碍。
在正常生理状态下,神经元和神经元、神经元与胶质细胞通过突触连接形成功能环路,在AD前期,Aβ开始聚集并在细胞外堆积,高水平的Aβ会通过多种机制改变突触强度,抑制突触活性,导致早期环路功能障碍,造成突触丢失并启动小胶质细胞介导的炎症反应。在AD的晚期,Aβ斑块形成,磷酸化的Tau蛋白介导的神经原纤维缠结,并且细胞质量控制途径出现障碍(比如细胞自噬);胶质细胞大量激活和增殖,加剧中枢炎症反应;神经元抑制性突触大量丢失,导致兴奋性神经元过度兴奋,引起神经网络障碍,损害记忆和认知功能。
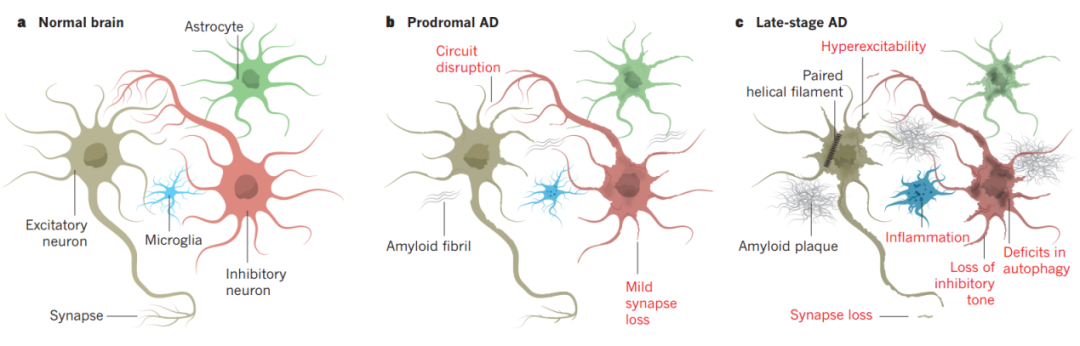
图2 AD进程中神经连接与突触结构的病变
二、Aβ堆积引起神经环路的脆性
Aβ在细胞间的传播方式类似于朊病毒在细胞间的传递,Aβ堆积会影响神经网络的连接功能,局部环路功能异常可能会导致Aβ在环路下游的堆积,引起Aβ在相连的环路中顺序扩散。对AD患者进行尸检发现Aβ堆积最开始发生在新皮层区域,后来逐渐发展到学习与记忆相关脑区,最后扩散到感觉和运动的相关脑区。Aβ的扩散顺序和AD病程恶化的顺序存在相似性。
针对Aβ的正电子发射断层扫描(PET)示踪剂的开发,有利于理解Aβ堆积对神经环路和认知障碍的影响。对AD患者的大脑进行PET研究,发现新皮层中存在大量的Aβ堆积,并且Aβ堆积与认知障碍密切相关。默认模式网络(default mode network, DMN)是在被动思考、记忆等过程中共激活的一组功能连接,DMN中Aβ的堆积会导致记忆障碍,AD患者DMN和Aβ高表达区存在重叠, DMN内部连通性降低,并出现记忆相关障碍,提示DMN活性降低是认知障碍的基础。
三、Aβ治疗策略与局限性
量实验结果表明Aβ的堆积促进了AD的发展,干预Aβ有可能成为治疗AD的有效方式。目前针对Aβ堆积的主要有两个策略,减少Aβ的异常产生和清除Aβ的过度堆积。调节β分泌酶活性会抑制蛋白水解生成的Aβ,是减少Aβ生成的主要策略,但是针对Aβ异常产生设计的药物,到了临床实验中均存在疗效不佳等诸多问题。清除 Aβ堆积的主要手段是通过小分子干扰肽诱导主动免疫或被动免疫清除Aβ,该方法在临床试验中可减少Aβ的堆积,减轻轻中度AD患者的认知障碍,但存在诸多严重的副作用。
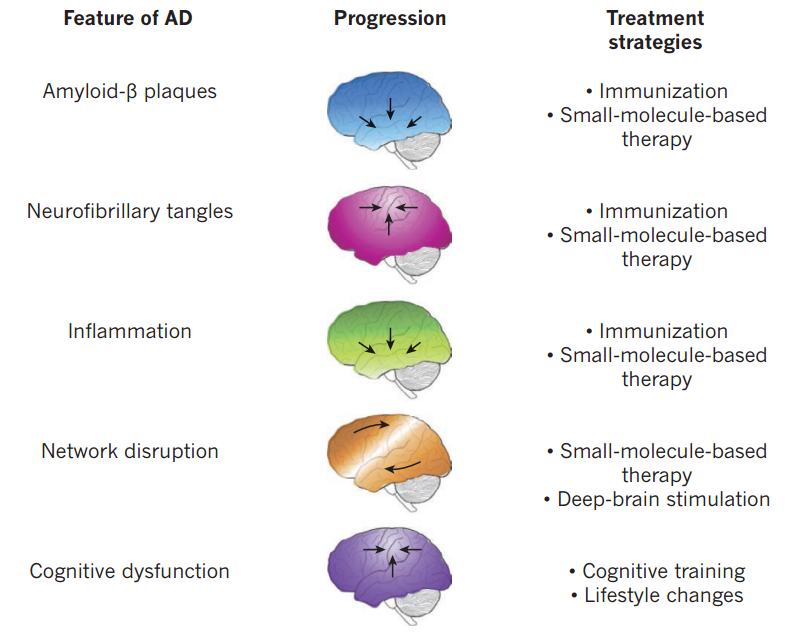
四、神经环路水平治疗AD的策略
胆碱能神经元表达于大脑皮质的不同部位,通过与其他核团相关连接,网络调节认知过程。在AD患者尸检样本中发现皮层胆碱能神经元大量丢失。胆碱能神经元缠结会导致记忆和认知网络障碍,单独增强胆碱能信号虽然不能逆转AD的进展,但是可以延缓记忆的丢失。越来越多的研究发现皮质胆碱能神经元缠结会增加记忆和认知网络的脆性,可作为AD早期的变化特征之一。
神经纤维缠结最初发生在皮质,然后会扩散到海马结构。在AD患者中发现内嗅皮层-海马及相关环路出现破坏,并且该破坏会影响学习和记忆过程,加剧认知障碍。此外,神经纤维缠结和Aβ均可在边缘系统进行广泛传播。
目前治疗AD的大多数方法都有潜在改善认知相关网络的作用。治疗AD早期的药物通过抑制乙酰胆碱的降解,提高胆碱能神经元的活性。治疗AD晚期的药物美金刚,则通过保持神经突触连接的完整性,减轻神经元的过度兴奋。直接靶向脑内神经网络有助于恢复记忆,深部脑刺激边缘皮质的穹窿(Fornix)结构,可改善认知功能,并增加DMN的活性。光遗传学激活海马神经元能增加树突棘的数量,并增强学习和记忆能力。
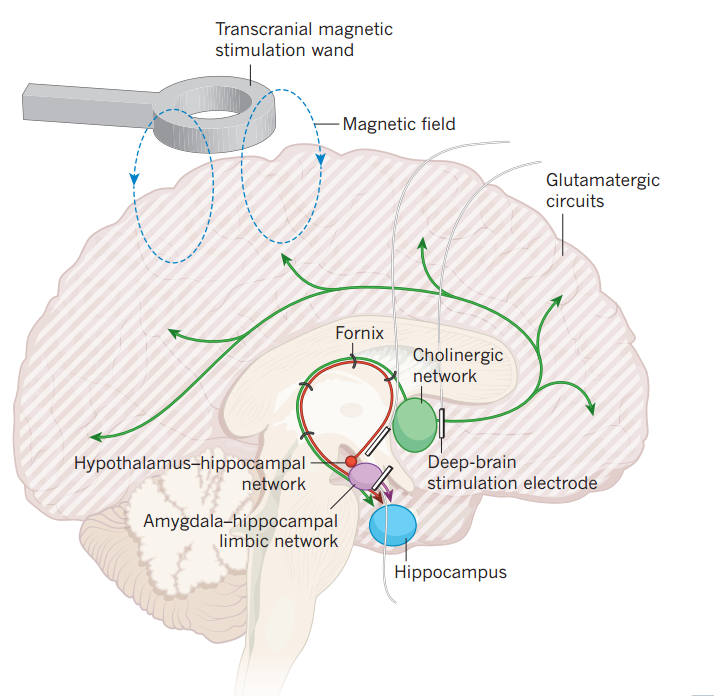
图4 神经环路水平治疗AD的策略
展望
随着人们对AD的认知水平不断提高,发现神经元功能异常降低投射神经网络的连接,恢复这些连接功能,有助于恢复丢失的记忆。但目前并没有单一策略能完全逆转认知障碍,因此有必要采取多渠道的方法治疗AD,重新建立起神经元的健康连接状态。
原文链接:https://pubmed.ncbi.nlm.nih.gov/27830780/
图片来源:Nature
如有相关实验需求,或了解更多产品和服务,欢迎扫码咨询我们!








